Das Verständnis der Rolle des Retentionsfaktors kann Probleme reduzieren und zur Entwicklung von stabileren Methoden beitragen.
Bei der Betrachtung der bei einer HPLC-Analyse generierten Daten liegt der Fokus naturgemäß auf der Retentionszeit, Peak-Asymmetrie, Peakfläche und Effizienz. Diese Parameter ermöglichen es dem Anwender, Analyten zu identifizieren und zu quantifizieren. Je präziser diese Informationen sind, desto größer ist das Vertrauen in die Peakidentität und die Analytkonzentration.
Der Retentionsfaktor ist ein oft übersehener Parameter von Trennungen, kann aber bei richtiger Anwendung zu einer robusteren Methode führen. Der Retentionsfaktor dient dazu, die Retentionszeit eines Analyten mittels der Totzeit zu normalisieren, und ist definiert als:
K’ = tr-t0/t0
Dabei ist tr die Retentionszeit des Analyten und t0 die Elutionszeit einer nicht-retinierten Verbindung. Die Bedeutung des Retentionsfaktors lässt sich am besten anhand eines Beispiels verdeutlichen:
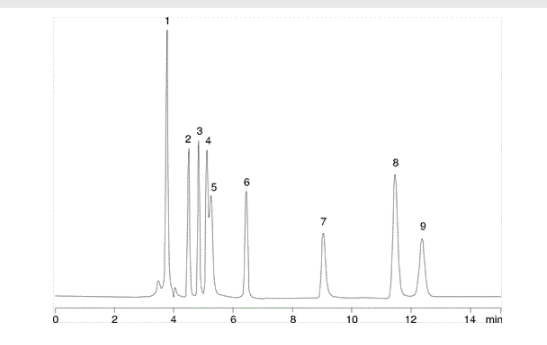
| 1. | Oxalsäure |
| 2. | Weinsäure/td> |
| 3. | Glykolsäure |
| 4. | Ameisensäure |
| 5. | Brenztraubensäure |
| 6. | Malonsäure |
| 7. | Essigsäure |
| 8. | Maleinsäure |
| 9. | Zitronensäure |
Hier haben wir eine Trennung von organischen Säuren auf einer C18-Säule durchgeführt, die unter 100 % wässrigen Bedingungen stabil ist. Die mobile Phase ist 20 mM Kaliumphosphatpuffer bei pH 2,9, mit einer Flussrate von 0,7 ml/min. Auf den ersten Blick wird die Oxalsäure fast 4 Minuten retiniert, aber bei genauerer Betrachtung beträgt die Totzeit t0 für diese Säule etwa 3,7 Minuten. Wenn man dies berücksichtigt, so wird deutlich, dass die Oxalsäure als sehr polare Disäure von der Säule kaum zurückgehalten wird.
K’ = 3,9-3,7/3,7 = 0,054
Das bedeutet, dass die Oxalsäure auf ihrem Weg durch die Säule fast keine Zeit in der stationären Phase verbringt. In solchen Fällen wird die Retention des Analyten durch kleine, unvorhergesehene Änderungen der Parameter stark beeinflusst:
- Zusammensetzung der mobilen Phase
- pH-Wert der mobilen Phase
- Stärke des Probenlösungsmittels
- Temperatur
Es ist daher unwahrscheinlich, dass eine solche Methode sehr robust ist, da die Retention der Oxalsäure von Lauf zu Lauf, von Säule zu Säule und von einer Charge der mobilen Phase zur nächsten variieren kann.
Dies führt zu der Empfehlung, dass bei der Entwicklung von Methoden die Retentionsfaktoren im Bereich von 2-10 liegen sollten. Wir haben gesehen, dass es bei Retentionsfaktoren von weniger als 2 zu Problemen kommen kann. Aber warum sollte der Retentionsfaktor nicht größer als 10 sein?
Bei einem isokratischen Lauf nimmt die Peakbreite mit zunehmender Retentionszeit aufgrund von Diffusion zu. Obwohl die Verwendung von Säulen mit kleineren Partikeln und einer optimalen Flussrate dazu beiträgt, diese Diffusion zu reduzieren, kann sie nicht eliminiert werden. Außerdem führen hohe Retentionsfaktoren letztlich zu langen Laufzeiten, die in einem produktiven Labor generell unerwünscht sind.
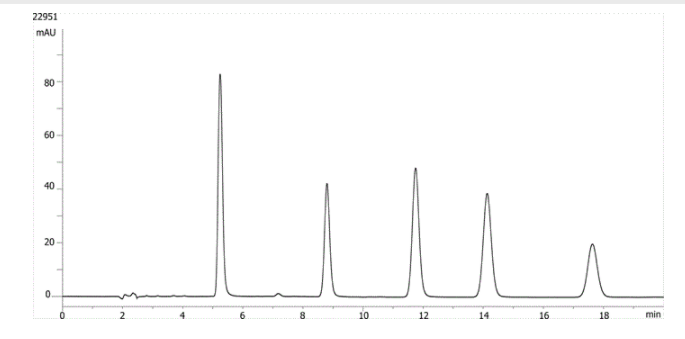
| 1. | Hydrocortison |
| 2. | Corticosteron |
| 3. | 11-a-Hydroxyprogesteron |
| 4. | Cortison-Acetat |
| 5. | 11-Ketoprogesteron |
Hier haben wir als Beispiel Steroide, die auf einer 150 x 4,6 mm Säule bei 1 ml/min analysiert werden. 11-Ketoprogesteron eluiert bei ca. 17,5 min, mit einem Retentionsfaktor von ca. 10,6. In diesem isokratischen Lauf ist eine Peakverbreiterung zu erkennen, was darauf hindeutet, dass der zuletzt eluierende Peak zu lange auf der Säule verbleibt.
Das Verständnis der Daumenregel (Retentionsfaktoren zwischen 2 und 10) ist hilfreich, lässt uns aber mit der Frage zurück, wie sie angepasst werden können.
Der Retentionsfaktor steht in umgekehrter Beziehung zur elutropen Stärke der mobilen Phase. Eine höhere elutrope Stärke senkt den Retentionsfaktor und umgekehrt. Wenn niedrige Retentionsfaktoren nicht durch eine Verringerung der elutropen Stärke der mobilen Phase erhöht werden können, kann es notwendig sein, auf eine alternative stationäre Phase zu wechseln, die zu einer größeren Retention der Analyten führt, z. B. durch die Verwendung einer stärker polaren stationären Phase für polare Analyten.