Astuce technique HPLC/UHPLC
Niveau : Avancé
Stratégies de développement de méthode pour les oligonucléotides
L’utilité clinique des oligonucléotides comme moyen pour contrôler l’expression des gènes suscite un intérêt croissant pour leur utilisation en thérapeutique. Les oligonucléotides ont des propriétés chimiques très différentes par rapport aux petites molécules. Cela en fait une cible intéressante mais rend également leur analyse plus difficile par rapport à celle de nombreuses petites molécules thérapeutiques. Ce sont des composés intrinsèquement polaires et ils nécessitent des conditions assez spécifiques pour permettre aux analystes de les caractériser pleinement, ainsi que leurs impuretés.
Dans cette série en deux parties, nous allons examiner les défis auxquels les scientifiques analytiques sont confrontés dans l'analyse des oligonucléotides et certains des leviers de développement de méthodes que vous pouvez actionner lorsque vous travaillez sur leur analyse.
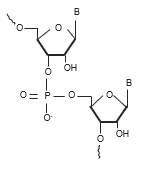
Les métodes traditionnelles pour l’analyse des oligonucléotides utilisent un agent d'appariement d'ions (généralement une alkylamine telle que la triéthylamine) pour faciliter leur rétention sur une colonne C18. Les phases C18 sont toujours préférées car elles offrent le plus haut niveau d'efficacité lorsque l'objectif est de séparer des impuretés qui éluent proches les unes des autres. Dans la première partie, nous examinons l’effet de la phase mobile, spécifiquement la paire d'ions alkylamine choisie, sur la résolution et la caractérisation.
Dans la littérature, la TEA est souvent citée comme une alkylamine standard à utiliser avec l'hexafluoroisoproanol (HFIP) pour l'analyse des oligonucléotides. Cependant, des études effectuées dans le laboratoire de Michael Bartlett1 suggèrent l’évaluation de différents types d'alkylamine lors du développement de méthode pour l’analyse d'oligonucléotides.
Quelques conseils pour le choix de l'alkylamine et de la concentration de l'alkylamine à utiliser dans votre méthode sont présentés ci-dessous. N'oubliez pas qu'il s'agit de conseils destinés à faciliter le développement de la méthode et qu'elles doivent faire partie d'une bonne conception expérimentale.
Des concentrations élevées d'alkylamine entraînent une augmentation du temps de rétention et une amélioration de l’efficacité d’ionisation (Fig. 1).
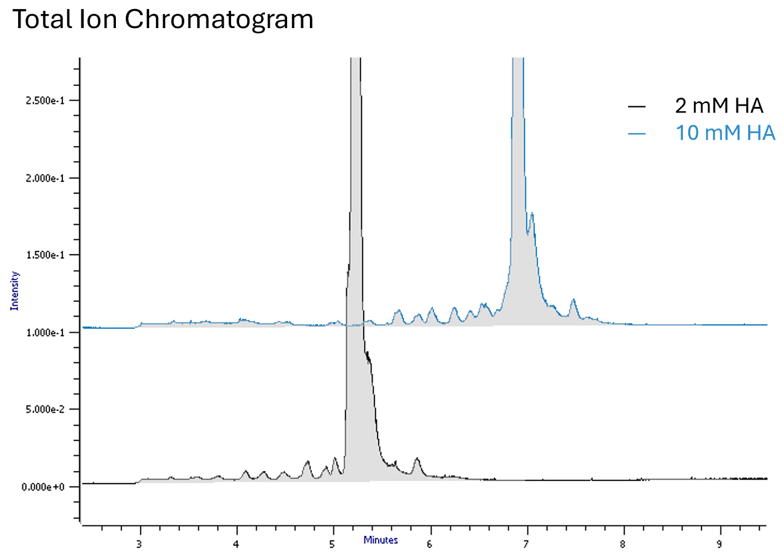
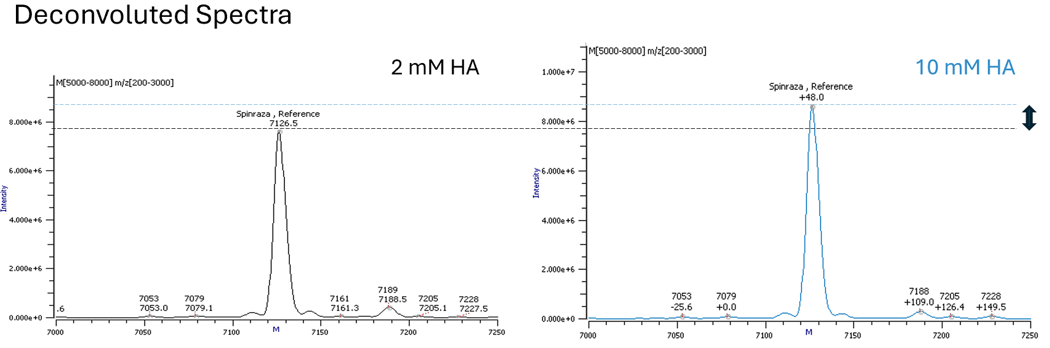
Fig. 1
| Colonne | Biozen 2,6 µm Oligo |
| Dimensions | 100 x 2,1 mm |
| Référence | 00D-4790-AN |
| Phase mobile A | 12,5 mM HFIP, Héxylamine dans l’eau |
| Phase mobile B | 12,5 mM HFIP, Héxylamine dans le MeOH |
| Gradient | 25-75% B en 14 minutes |
| Débit | 0,3 ml/min |
| Detection | TOF-MS |
| Température | 65 °C |
| Échantillon | Nusinersen |
La concentration d'alkylamine peut être un problème, car les agents d’appariement d’ions peuvent persister dans votre système LC et votre interface MS si vous n'avez pas mis en place un lavage approprié du système. Si c'est le cas, vous pouvez évaluer d'autres stratégies pour réduire la quantité d'alkylamine au départ.
L'utilisation d'une alkylamine plus hydrophobe, telle que l'hexylamine (HA), peut vous permettre de réduire la concentration de l’agent pair d’ions et d'utiliser une proportion plus élevée de solvant organique dans votre gradient (Fig. 2). Un temps de rétention plus long, une proportion plus élevée de solvant organique dans votre phase mobile et une concentration plus faible de l’agent paire d’ions contribueront à rendre l'ionisation plus efficace (Fig. 3).
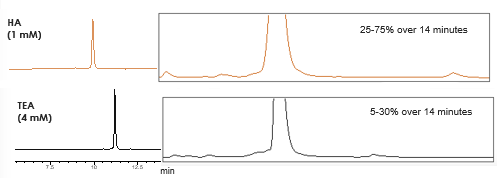
Fig. 2
| Colonne | Biozen 2,6 µm Oligo |
| Dimensions | 100 x 2,1 mm |
| Phase mobile | A: 12,5 mM HFIP, Amine comme indiqué dans l'eau B: 12,5 mM HFIP, Amine comme indiqué dans le méthanol |
| Débit | 0,3 ml/min |
| Gradient | Comme indiqué (% de B) |
| Température | 65 °C |
| Detection | UV à 260 nm |
| Échantillon | BNA |
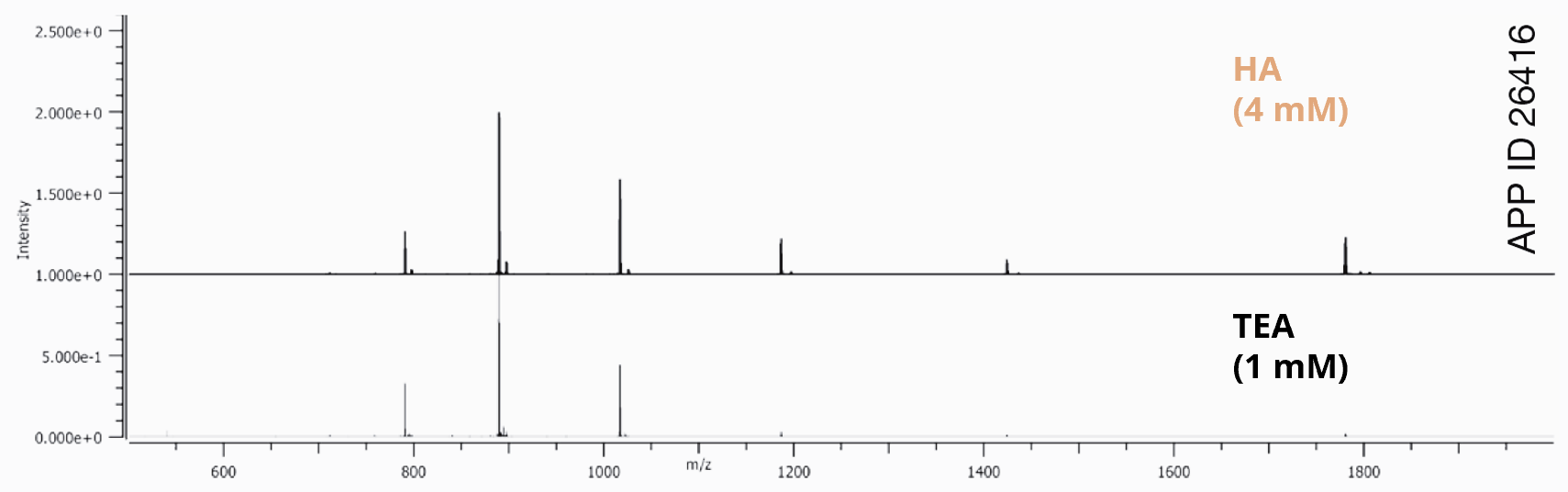
Fig. 3
| Colonne | Biozen 2,6 µm Oligo |
| Dimensions | 100 x 2,1 mm |
| Référence | 00D-4790-AN |
| Phase mobile A | 12,5 mM HFIP, 1 mM TEA dans l’eau 12,5 mM HFIP, 4 mM HA dans l’eau |
| Phase mobile B | 12,5 mM HFIP, 1 mM TEA dans le méthanol 12,5 mM HFIP, 4 mM HA dans le méthanol |
| Gradient | 5-75 % B en 14 min |
| Débit | 0,3 ml/min |
| Detection | TOF-MS |
| Température | 65 °C |
| Échantillon | 2’-MOE Gapmer (200 ng) |
Une dernière considération lors du choix d’un agent d’appariement d’ions est la solubilité. Lorsque la solubilité de l’agent paire d'ions est plus faible dans la phase mobile, l’appariement d’ions est favorisé. Cependant, dans le cas de l'octylamine, cet additif est beaucoup moins soluble dans les phases mobiles très aqueuses et nécessite davantage de solvant organique. Les niveaux élevés d'organique qui sont nécessaires pour solubiliser l'agent d'appariement d'ions le rendent « moins utilisable » dans certaines situations, en particulier lors de l'analyse d'oligonucléotides plus courts qui ne sont pas bien retenus avec un niveau de phase organique élevé.
En résumé, il n'y a pas de solution unique lorsqu'il s'agit de choisir le meilleur agent d'appariement d'ions pour l'analyse des oligonucléotides, mais le respect de quelques conseils simples peut améliorer de manière significative les données de caractérisation que vous êtes en mesure d'obtenir pour votre analyse.
1 Basiri, B.; Murph, M. M.; Bartlett, M. G. J Am Soc Mass Spectrom. 2017, 28(8), 1647–1656
Visionnez nos webinaires enregistrés gratuits

Marques commerciales
Biozen appartient à Phenomenex.


