Wskazówki techniczne HPLC / UHPLC
Poziom: Zaawansowany
Strategie rozwoju metod dla oligonukleotydów
Kliniczna użyteczność oligonukleotydów jako środków kontroli ekspresji genów sprawia, że stają się one coraz bardziej interesujące jako związki o potencjale terapeutycznym. Oligonukleotydy mają bardzo różne właściwości chemiczne w porównaniu do typowych leków małocząsteczkowych. Czyni je to interesującym celem badań, ale również sprawia, że ich analiza jest bardziej skomplikowana niż w przypadku wielu związków małocząsteczkowych.
W tej dwuczęściowej serii przyjrzymy się wyzwaniom, z jakimi mierzą się analitycy zajmujący się badaniami oligonukleotydów, a także rozwojowi metod w tej dziedzinie.
Tradycyjne metody badań oligonukleotydów wykorzystują odczynniki par jonowych (zazwyczaj alkiloaminy, takie jak trietyloamina), aby ułatwić retencję związków na kolumnie C18. Preferowane w tym przypadku są kolumny C18, ponieważ wykazują najwyższy poziom sprawności, gdy celem jest rozdzielenie blisko eluujących zanieczyszczeń. W pierwszej części przyjrzymy się wpływowi fazy ruchomej na rozdzielczość i cechy charakterystyczne analizy, stosując wybrany alkiloamoniowy odczynnik par jonowych.
W literaturze TEA jest często wymieniana jako standardowa alkiloamina, którą należy stosować wraz z heksafluoroizoproanolem (HFIP) do analizy oligonukleotydów. Jednakże badania przeprowadzone przez Michaela Bartletta w jego laboratorium sugerują, że różne rodzaje alkiloamin powinny być brane pod uwagę przy opracowywaniu metod analizy oligonukleotydów.1
Poniżej przedstawiono ogólne wytyczne dotyczące wyboru alkiloamin i ich stężeń do wykorzystania w Twojej metodzie. Pamiętaj, że są to wytyczne, które mają pomóc przy opracowywaniu metody i powinny stanowić część dobrego projektu eksperymentalnego.
Wyższe stężenie alkiloaminy prowadzi do wydłużenia czasu retencji i lepszej energii jonizacji (Rys. 1).
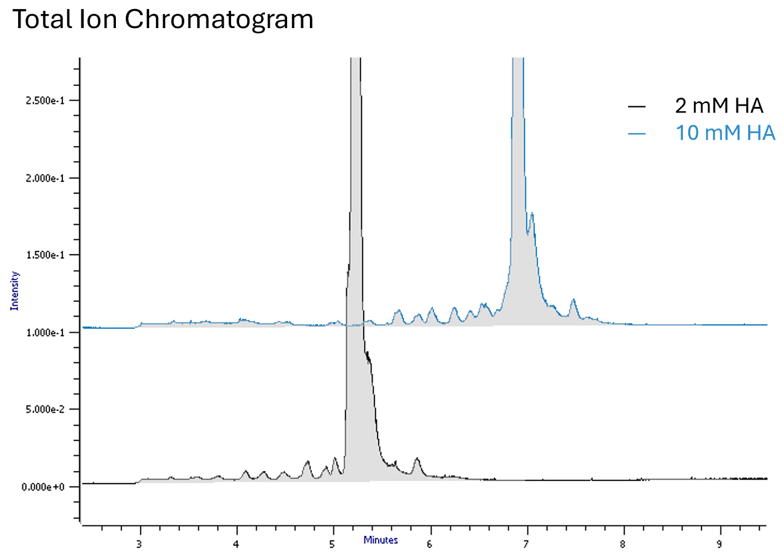
Rys. 1
| Kolumna | Biozen™ 2.6 µm Oligo |
| Wymiary | 100 x 2,1 mm |
| Nr kat. | 00D-4790-AN |
| Faza ruchoma A | 12,5 mM HFIP, heksyloamina w wodzie |
| Faza ruchoma B | 12,5 mM HFIP, heksyloamina w MeOH |
| Gradient | 25-75% B w 14 minut |
| Przepływ | 0,3 mL/min |
| Detekcja | TOF-MS |
| Temperatura | 65 °C |
| Próbka | Nusinersen |
Stężenie alkiloamin należy wziąć pod uwagę, ponieważ mogą one pozostawać w systemie LC, jeśli nie przeprowadzono odpowiedniego płukania aparatury. W takim przypadku istnieją również inne strategie, które można zastosować w celu zmniejszenia ilości alkiloamin.
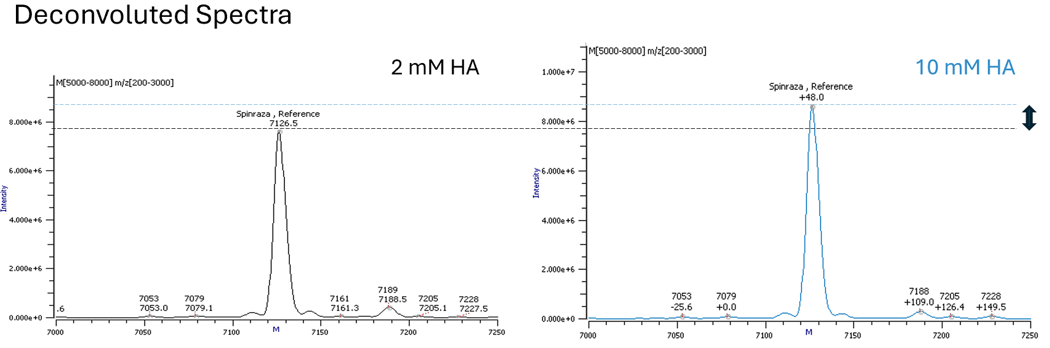
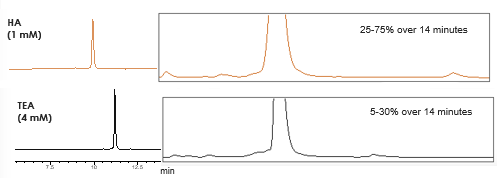
Użycie bardziej hydrofobowej alkiloaminy, takiej jak heksyloamina (HA), pozwala na zmniejszenie stężenia odczynnika par jonowych i prowadzenie gradientu z wyższym udziałem rozpuszczalnika organicznego (Rys. 2). Dłuższy czas retencji, wyższy udział rozpuszczalnika organicznego w fazie ruchomej oraz niższe stężenie odczynnika par jonowych przyczyniają się do wyższej wydajności jonizacji (Rys. 3).
Rys. 2
| Kolumna | Biozen 2.6 µm Oligo |
| Wymiary | 100 x 2.1 mm |
| Faza ruchoma | A: 12,5 mM HFIP, HA or TEA (jak wskazano) w wodzie B: 12,5 mM HFIP, HA or TEA (jak wskazano) w metanolu |
| Przepływ | 0,3 mL/min |
| Gradient | Jak pokazano (w % B) |
| Temperatura | 65 °C |
| Detekcja | UV @ 260 nm |
| Próbka | BNA |
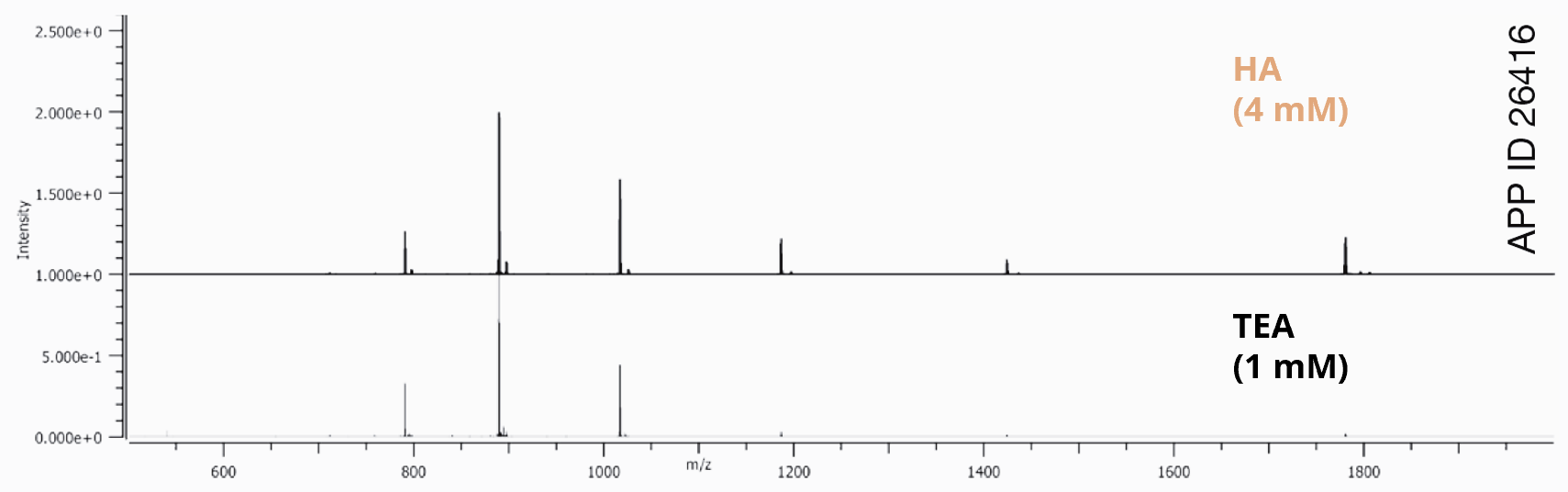
Rys. 3
| Kolumna | Biozen 2.6 µm Oligo |
| Wymiary | 100 x 2.1 mm |
| Nr kat. | 00D-4790-AN |
| Faza ruchoma A | 12,5 mM HFIP, 1 mM TEA w wodzie 12,5 mM HFIP, 4 mM HA w wodzie |
| Faza ruchoma B | 12,5 mM HFIP, 1 mM TEA w metanolu 12,5 mM HFIP, 4 mM HA w metanolu |
| Gradient | 5-75 % B in 14 w 14 minut |
| Przepływ | 0,3 mL/min |
| Detekcja | TOF-MS |
| Temperatura | 65 °C |
Ostatnią rzeczą, którą należy rozważyć przy wyborze odczynnika par jonowych jest jego rozpuszczalność. Gdy rozpuszczalność odczynnika w fazie ruchomej jest niewystarczająca, można zaobserwować pewne wzmocnienie tworzenia się par jonowych. Przykładowo, oktyloamina jako odczynnik słabo rozpuszczalny w fazach ruchomych o dużej zawartości wody, wymaga więcej rozpuszczalnika organicznego. Wysokie stężenia rozpuszczalników organicznych, które są wymagane do rozpuszczenia odczynników par jonowych, sprawiają, że nie mają one zastosowania we wszystkich sytuacjach. Przykładowo, w analizie oligonukleotydów o krótszych łańcucach, które nie są dobrze zatrzymywane przy wysokiej zawartości rozpuszczalników organicznych w fazie ruchomej.
Podsumowując, nie ma jednej idealnej zasady, jeśli chodzi o wybór najlepszego odczynnika par jonowych w analizie oligonukleotydów. Jednakże przestrzeganie kilku prostych wskazówek może znacznie poprawić dane otrzymywane podczas Twoich analiz.
1 Basiri, B.; Murph, M. M.; Bartlett, M. G. J Am Soc Mass Spectrom. 2017, 28(8), 1647–1656
Obejrzyj nasze bezpłatne webinaria na żądanie

Znaki towarowe
Biozen jest znakiem towarowym firmy Phenomenex.


