Suggerimento tecnico HPLC/UHPLC
Livello: Avanzato
Oligonucleotidi: Strategie di sviluppo metodo
L'utilità clinica degli oligonucleotidi come mezzo per controllare l'espressione genica ha contribuito al crescente interesse verso il loro utilizzo come farmaci. Gli oligonucleotidi sono un "target" interessante anche in virtù delle loro proprietà chimiche, molto diverse da quelle dei classici farmaci. Purtroppo, la loro analisi sono di gran lunga più complicate rispetto a quelle di molte piccole molecole terapeutiche. Trattandosi di composti estremamente polari, le condizioni analitiche, necessarie alla caratterizzare completa sia dell'oligonucleotide che delle sue impurezze, sono specifiche e selettive.
In questa serie in due parti, troverete sia le sfide che gli analisti affrontano nell'analisi degli oligonucleotidi sia alcuni "approcci" utilizzati per velocizzare il processo analitico.
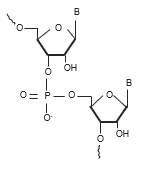
Le metodiche analitiche, utilizzate per la caratterizzazione degli oligonucleotidi, prevedono l'utilizzo di un agente di coppia ionica (tipicamente un'alchilammina, come la trietilammina) per facilitarne la ritenzione su colonne alchiliche (C18). Le fasi C18 sono ancora oggi le fasi maggiormente utilizzate grazie alla loro alta efficienza, necessaria per separare impurezze con profili cromatografici molto simili tra loro. In questa prima parte, affronteremo l'effetto dell'agente di coppia ionica sulla risoluzione.
In letteratura, la trietil ammina (TEA) è indicata come alchilammina più promettente da utilizzare insieme all'esafluoroisoproanolo (HFIP) per l'analisi degli oligonucleotidi. Tuttavia, studi condotti da Michael Bartlett1 suggeriscono di valutare diverse alchilammine quando si sviluppa un metodo per l'analisi degli oligonucleotidi.
Di seguito sono riportate le linee guida generali per la scelta dell'alchilammina e della relativa concentrazione da utilizzare nel metodo. Si prega di tenere presente che si tratta di semplici linee guida da consultare in fase di sviluppo e che normalmente dovrebbero far parte di una buona progettazione sperimentale.
Concentrazioni più elevate di alchilammina portano ad un aumento del tempo di ritenzione e a una efficace ionizzazione MS (Fig. 1).
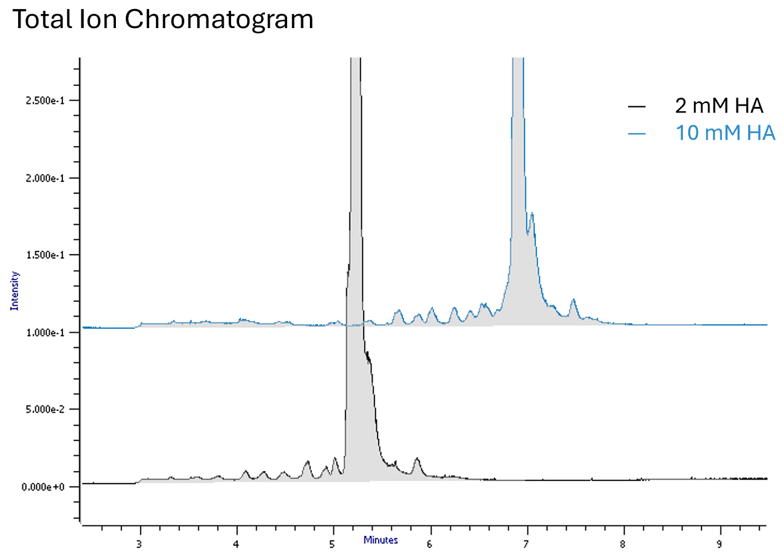
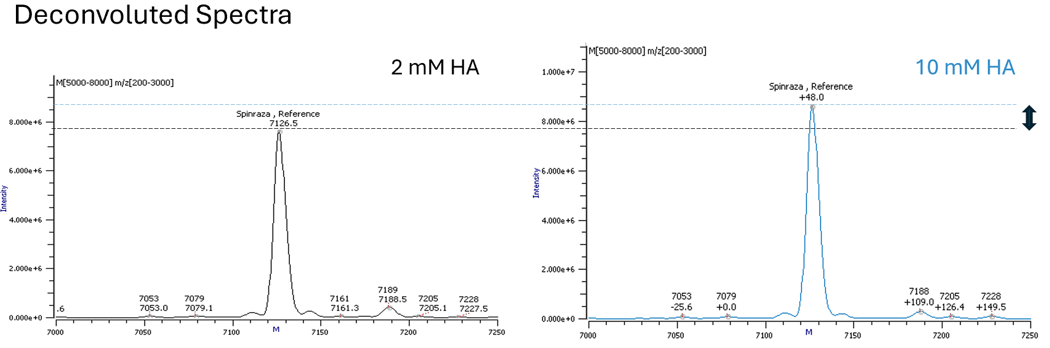
Fig. 1
| Colonna | Biozen™ 2.6 µm Oligo |
| Dimensioni | 100 x 2.1 mm |
| Referenza | 00D-4790-AN |
| Fase Mobile A | 12.5 mM HFIP, Esilammina in Acqua |
| Fase Mobile B | 12.5 mM HFIP, Esilammina in MeOH |
| Gradiente | 25-75% B in 14 minuti |
| Flusso | 0.3 mL/min |
| Detection | TOF-MS |
| Temperatura | 65 °C |
| Campione | Nusinersen |
La concentrazione di alchilammina può essere un problema, in quanto può portare a contaminazione del sistema LC, in particolare se non è stato aggiunto un adeguato step di lavaggio al metodo cromatografico. Tieni presente che ci sono altre strategie da valutare e adottare per ridurre la quantità di alchilammina prevista dal metodo.
Con l'utilizzo di un'alchilammine più idrofobica, come l'esilammina (HA), è possibile utilizzare una concentrazione più bassa di accoppiante e, allo stesso tempo, una percentuale più elevata di solvente organico nel tuo gradiente (Fig. 2) . Una buona ritenzione degli oligonucleotidi, l'eluizione degli stessi ad alte percentuali di solvente organico e una riduzione della concentrazione complessiva di accoppiante aiuta a migliorare la ionizzazione (Fig. 3).
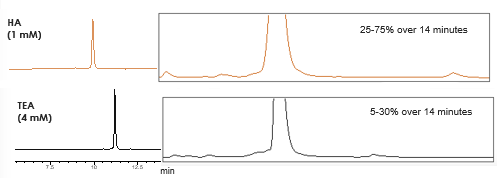
Fig. 2
| Colonna | Biozen™ 2.6 µm Oligo |
| Dimensioni | 100 x 2.1 mm |
| Fase Mobile | A: 12.5 mM HFIP, HA o TEA (come indicato) in acqua B: 12.5 mM HFIP, HA or TEA (ome indicato) in metanolo |
| Flusso | 0.3 mL/min |
| Gradiente | As shown (in % B) |
| Temperatura | 65 °C |
| Detection | UV @ 260 nm |
| Campione | BNA |
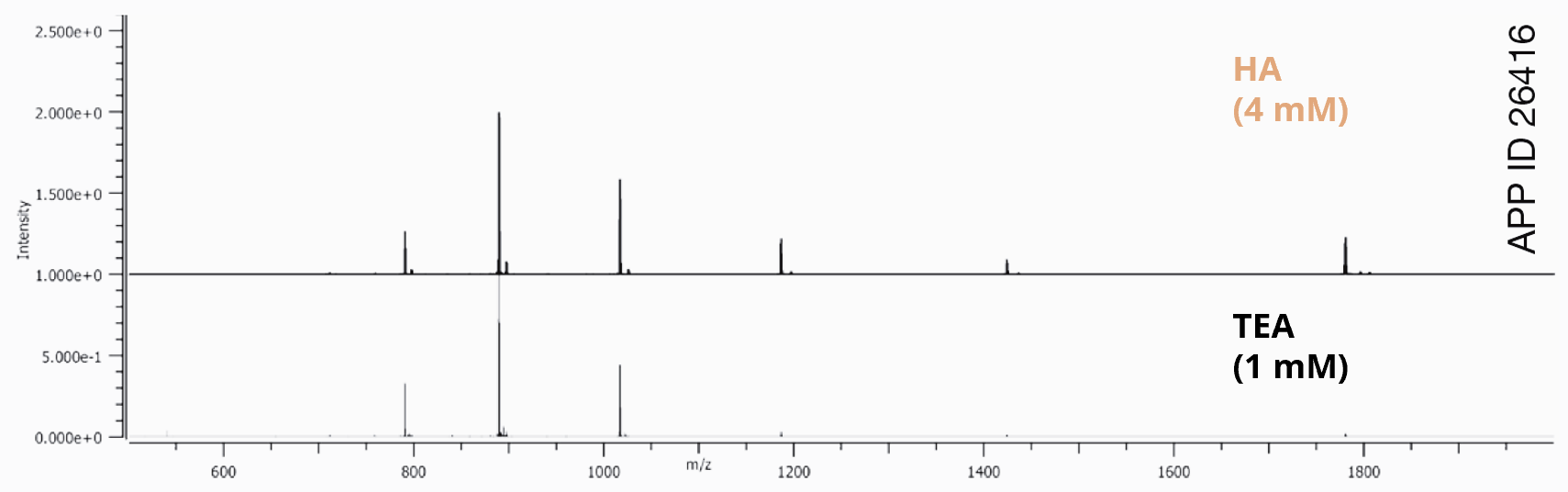
Fig. 3
| Colonna | Biozen 2.6 µm Oligo |
| Dimensioni | 100 x 2.1 mm |
| Referenza | 00D-4790-AN |
| Fase Mobile A | 12.5 mM HFIP, 1 mM TEA in Acqua 12.5 mM HFIP, 4 mM HA in Acqua |
| Fase Mobile B | 12.5 mM HFIP, 1 mM TEA in Metanolo 12.5 mM HFIP, 4 mM HA in Metanolo |
| Gradiente | 5-75 % B in 14 min |
| Flusso | 0.3 mL/min |
| Detection | TOF-MS |
| Temperatura | 65 °C |
| Campione | 2’-MOE Gapmer (200 ng) |
L'ultimo aspetto da considerare è la solubilità dell'agente di coppia ionica, in quanto, in condizioni di scarsa solubilità nella fase mobile acquosa è possibile osservare un aumento degli effetti di coppia ionica. Tuttavia, se prendiamo l'octilamina come esempio, essendo l'ammina poco solubile in fasi mobili altamente acquose si rende necessario l'utilizzo di percentuali di organico nel metodo eccessivamente alte. In questo caso, la solubilità diventa un fattore limitante, in particolare quando si analizzano oligonucleotidi a basso peso molecolare che sono poco trattenuti ad alte percentuali di organico.
In sintesi, non esiste un modo univoco per la scelta dell'accoppiante migliore, e difatti l'unica cosa da fare è seguire alcune semplici linee guida che possono aiutarti ad ottenere un miglioramento significativo a livello analitico.
1 Basiri, B.; Murph, M. M.; Bartlett, M. G. J Am Soc Mass Spectrom. 2017, 28(8), 1647–1656
Guarda i webinar on-demand

Marchi commerciali
Biozen è un marchio commerciale di Phenomenex.


