HPLC/UHPLC Technischer Tipp
Niveau: Fortgeschritten
Methodenentwicklungsstrategien für Oligonukleotide
Tipps in anderen Sprachen
Der klinische Nutzen von Oligonukleotiden als Mittel zur Kontrolle der Genexpression macht sie als Therapeutika zunehmend interessant. Oligonukleotide haben ganz andere chemische Eigenschaften als typische Medikamente basierend auf kleinen Molekülen, weshalb sie vielversprechende Kandidaten für die Wirkstoffforschung sind. Das macht aber auch ihre Analyse komplizierter als bei vielen Therapeutika basierend auf kleinen Molekülen. Oligonukleotide sind von Natur aus polare Verbindungen und erfordern recht spezifische Bedingungen, damit man sie und ihre Verunreinigungen vollständig charakterisieren kann.
In dieser zweiteiligen Serie werden wir die Herausforderungen betrachten, denen Wissenschaftler bei der Analyse von Oligonukleotiden gegenüberstehen, sowie einige der Methodenentwicklungshebel, die sie bei ihrer Analyse einsetzen könnten
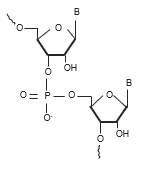
Traditionelle Oligonukleotid-Methoden verwenden ein Ionenpaar-Reagens (typischerweise ein Alkylamin wie Triethylamin), um ihre Retention auf einer C18-Säule zu erhöhen. C18-Phasen werden immer noch bevorzugt, da sie die höchste Effizienz bieten, wenn es darum geht, nahe beieinander eluierende Verunreinigungen aufzulösen. In diesem ersten Teil werden wir die Auswirkungen der mobilen Phase, insbesondere des gewählten Alkylamin-Ionenpaars, auf die Auflösung und Charakterisierung betrachten.
In der Literatur wird TEA oft als Standard-Alkylamin aufgeführt, das neben Hexafluorisoproanol (HFIP) bei der Analyse von Oligonukleotiden verwendet wird. Die Studien von Michael Bartlett legen jedoch nahe, dass bei der Entwicklung einer Methode zur Analyse von Oligonukleotiden die verschiedenen Alkylamin-Typen evaluiert werden sollten.1
Im Folgenden werden einige allgemeine Richtlinien zur Auswahl des Alkylamins und der Alkylaminkonzentration für den Einsatz in Ihrer Methode skizziert. Bitte beachten Sie, dass es sich hierbei um Richtlinien zur Unterstützung der Methodenentwicklung handelt, die Teil einer guten Versuchsplanung sein sollten.
Höhere Konzentrationen des Alkylamins führen zu einer längeren Retentionszeit und einer besseren Ionisierungseffizienz (Abb. 1)
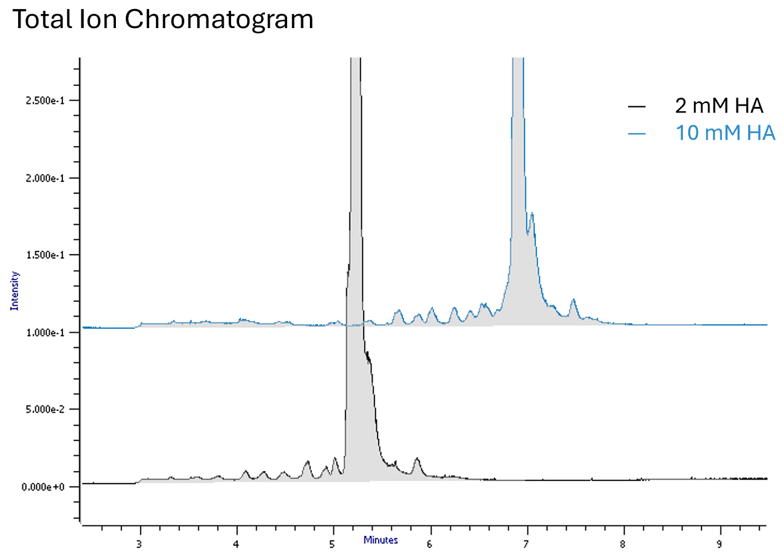
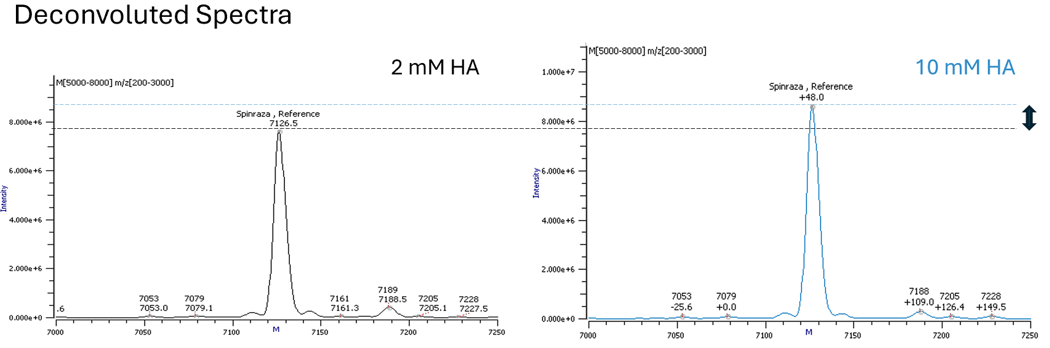
Abb. 1
| Säule | Biozen 2.6 µm Oligo |
| Abmessungen | 100 x 2.1 mm |
| Artikelnummer | 00D-4790-AN |
| Mobile Phase A | 12,5 mM HFIP, Hexylamin in Wasser |
| Mobile Phase B | 12,5 mM HFIP, Hexylamin in MeOH |
| Gradient | 25-75% B in 14 Minuten |
| Flussrate | 0,3 ml/min |
| Detektion | TOF-MS |
| Temperatur | 65 °C |
| Probe | Nusinersen |
Die Alkylaminkonzentration kann ein Grund zur Sorge sein, da Ionenpaare in Ihrem LC-System und der MS-Schnittstelle verweilen können, wenn Sie keine ordnungsgemäße Reinigung durchgeführt haben. In solchen Fällen gibt es andere Strategien, um die Menge des Alkylamins von vornherein zu reduzieren.
Die Verwendung eines hydrophoberen Alkylamins, wie z. B. Hexylamin (HA), kann es Ihnen ermöglichen, die Konzentration des Ionenpaars zu verringern und einen höheren Anteil an organisches Lösungsmittel in Ihrem Gradienten zu verwenden (Abb.2). Eine längere Retentionszeit, ein höherer Anteil an organisches Lösungsmittel in der mobilen Phase und eine geringere Konzentration des Ionenpaars tragen alle zu einer höheren Ionisierungseffizienz bei (Abb. 3).
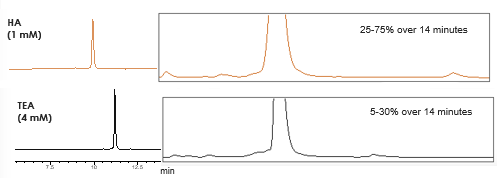
Abb. 2
| Säule | Biozen™ 6 µm Oligo |
| Abmessungen | 100 x 2.1 mm |
| Mobile Phase | A: 12,5 mM HFIP, HA oder TEA (wie angegeben) in Wasser B: 12,5 mM HFIP, HA oder TEA (wie angegeben) in Methanol |
| Flussrate | 0,3 ml/min |
| Gradient | Wie gezeigt (in % B) |
| Temperatur | 65 °C |
| Detektion | UV @ 260 nm |
| Probe | BNA |
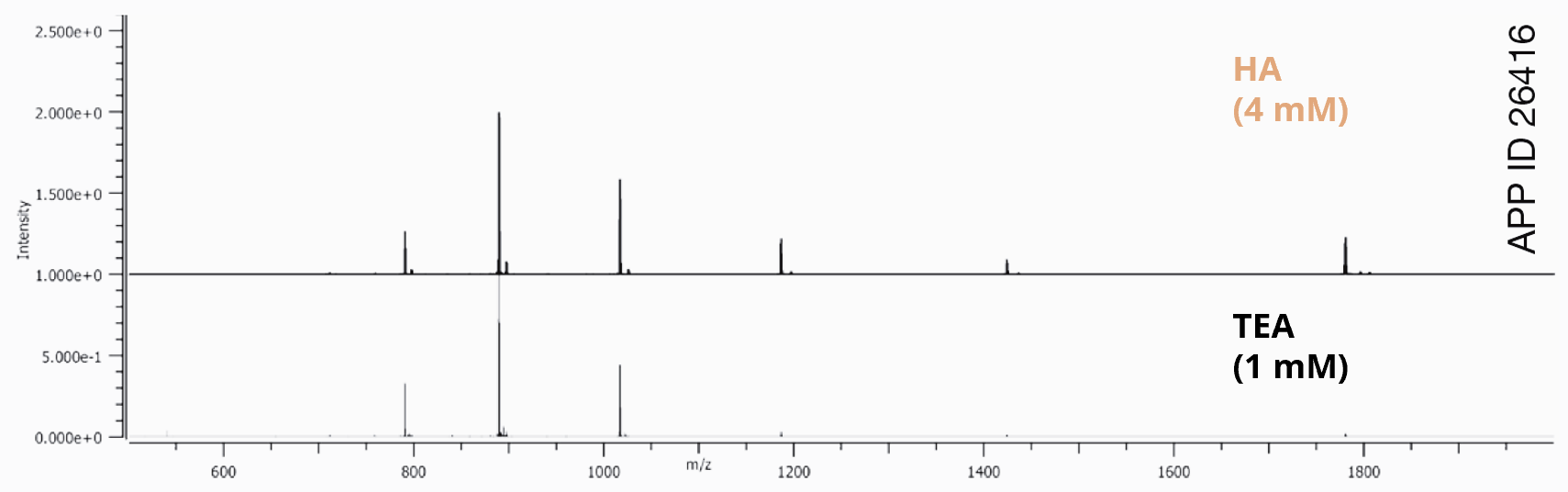
Abb. 3
| Säule | Biozen 2.6 µm Oligo |
| Abmessungen | 100 x 2.1 mm |
| Artikelnummer | 00D-4790-AN |
| Mobile Phase A | 12,5 mM HFIP, 1 mM TEA in Wasser 12,5 mM HFIP, 4 mM HA in Wasser |
| Mobile Phase B | 12,5 mM HFIP, 1 mM TEA in Methanol 12,5 mM HFIP, 4 mM HA in Methanol |
| Gradient | 5-75 % B in 14 min |
| Flussrate | 0,3 ml/min |
| Detektion | TOF-MS |
| Temperatur | 65 °C |
| Probe | 2’-MOE Gapmer (200 ng) |
Ein letzter Punkt, den Sie bei der Auswahl eines Ionenpaar-Reagens berücksichtigen sollten, ist die Löslichkeit. Wenn die Löslichkeit des Ionenpaar-Reagens in der mobilen Phase geringer ist, können Sie eine gewisse Verstärkung der Ionenpaarbildung feststellen. Nehmen wir jedoch Octylamin als weiteres Beispiel, so ist dieses Additiv in stark wässrigen mobilen Phasen sehr viel schlechter löslich und erfordert einen höheren Anteil der organischen Komponente. Der hohe Organikanteil, der zur Löslichkeit des Ionenpaar-Reagens erforderlich ist, macht es nicht in allen Situationen anwendbar, insbesondere bei der Analyse kürzerer Oligonukleotide, die mit hohem organischen Anteil nicht gut retiniert werden.
Zusammenfassend lässt sich sagen, dass es kein Patentrezept gibt, wenn es darum geht, das beste Ionenpaar-Reagens für die Analyse von Oligonukleotiden auszuwählen. Aber die Befolgung einiger einfacher Richtlinien kann die Qualität der Analysedaten, die Sie bei der Charakterisierung Ihrer Oligonukleotide erhalten, erheblich verbessern.
1 Basiri, B.; Murph, M. M.; Bartlett, M. G. J Am Soc Mass Spectrom. 2017, 28(8), 1647–1656
Entdecken Sie unsere kostenlosen On-Demand-Webinare

Marken: Biozen ist eine Marke von Phenomenex


