Wskazówki techniczne HPLC / UHPLC
Poziom: Podstawy
Systematyczne podejście do analizy peptydów
Słowem wstępu
Peptydy są często uważane za bliższe małym cząsteczkom, jeśli chodzi o rozwój metod chromatograficznych. Stanowią one jednak pomost między małymi cząsteczkami (tradycyjnymi farmaceutykami) a większymi biomolekułami (białkami, AAV, oligonukleotydami). Analizując peptydy, nie możemy po prostu brać pod uwagę właściwości aminokwasów wchodzących w ich skład, ponieważ ich właściwości zależą nie tylko od tych bloków budulcowych, ale także od sekwencji wiązania w łańcuchu peptydowym, a także od sposobu, w jaki łańcuchy peptydowe są zwinięte lub złożone w przestrzeni. Z tego powodu peptydy mogą zachowywać się inaczej niż małe cząsteczki, gdy analizuje się je za pomocą HPLC.
Wskazówka
Początkowe opracowanie metody dla peptydów powinno rozpocząć się od procesu, podczas którego sprawdzane są różne fazy stacjonarne, zaczynając od typowej fazy alkilowej. Jeśli uzyskany profil nie zapewnia pożądanej selektywności, należy przejść do fazy alternatywnej, najlepiej o zupełnie innych właściwościach.
Gradient fazy ruchomej jest również ważną zmienną, którą należy wziąć pod uwagę przy analizie peptydów. Zazwyczaj obserwuje się znacznie płytsze gradienty niż w przypadku pracy z małymi cząsteczkami. W celu optymalizacji gradientu w analizie peptydów zalecamy rozpoczęcie od niskiej zawartości części organicznej, aby skupić peptydy na przedniej części kolumny i zastosować płytkie nachylenie do 50-60% części organicznej, w którym wszystkie peptydy powinny się eluować (typowy jest wzrost o 1% B na minutę). Należy również wziąć pod uwagę pH roztworu próbki i fazy ruchomej, ponieważ wpływa to na właściwości fizykochemiczne peptydów, a w rezultacie na ich czas retencji. Wreszcie, należy wziąć pod uwagę charakter rozpuszczalnika eluującego, którym zazwyczaj dla peptydów jest acetonitryl.
Po przeprowadzeniu wstępnego badania można przeprowadzić optymalizację metody poprzez zmianę innych parametrów metody (rys. 1). Najbardziej dramatycznym z nich pod względem wpływu na selektywność jest pH (rys. 2).
Rys. 1
| Zmienna | Rozwiązanie |
|---|---|
| Szybkość przepływu | Mniejszy wpływ na peptydy niż na małe cząsteczki |
| pH | Niewielka zmiana może mieć duży wpływ |
| Nachylenie gradientu | Zmiany gradientu znacząco wpływają na selektywność |
| Temperatura | 40-90⁰C |
| Typ buforu | Wiele roztworów, w tym TFA, kwas mrówkowy, HFBA, bufory fosforanowe |
Rys. 2
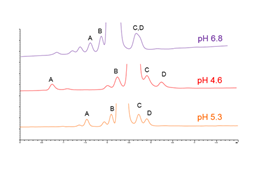
Kolumna: Kinetex EVO C18 5µm
Wymiary: 250 x 4.6mm
Faza ruchoma A: 50 mM octan amonu w wodzie; acetonitryl (v/v 97:3), pH jak wskazano
Faza ruchoma B: 50mM octan amonu w wodzie: Acetonitryl (v/v 60:40), pH jak wskazano
Przepływ: 1.5 mL/min
Program: 14-34% B, 40 minut, rampa do 80%
Detecktor: UV-Vis @ 220nm
Temperatura: 65oC
Próbka: Syntetyczny peptyd 12 AA z zanieczyszczeniami produkcyjnymi
Fazy stacjonarne odgrywają ważną rolę w procesie rozwoju i zaleca się zbadanie różnych typów kolumn (rys. 3).
| Kolumna | Przykład | Właściwości | Grupy peptydów |
|---|---|---|---|
| C18 pierwszego wyboru | KinetexTM EVO C18 | Stabilność przy wysokim pH | Profilowanie zanieczyszczeń, w tym stereoizomerycznych zanieczyszczeń |
| Alternatywna C18 | BiozenTM Peptide PS-C18 | Mieszany typ oddziaływań C18 | Peptydy zasadowe Peptydy polarne |
| C8 | Kinetex C8 | Różna gęstość wiązania | Bardzo hydrofobowe peptydy. Selektywność alternatywna do C18 |
| Aromatyczne / fenylowe | Kinetex Biphenyl | Unikalna, hydrofobowa, arylenowa i polarna selektywność | Bardzo hydrofobowe peptydy Peptydy cykliczne Peptydy z aromatycznymi łańcuchami bocznymi |
Wnioski
Opracowanie systematycznego podejścia do opracowywania metod analizy syntetycznych peptydów pozwoli na dokładne oznaczanie ilościowe i oczyszczanie peptydów w odpornym i niezawodnym procesie. Wybór kolumn i pH ma ogromne znaczenie, a dobrze buforowane i kontrolowane układy pomiarowe są koniecznością. Postępowanie zgodnie z procesem Quality by Design (QbD) upraszcza tę strategię i łączy wszystkie ważne elementy podczas opracowywania metody.
DARMOWY plakat dotyczący selektywności HPLC
Plakat selektywności HPLC pokazuje, jak rozdzielać:
• Związki węglowodorowe
• Związki funkcyjne zawierające grupę hydroksylową lub aminową
• Izomery, związki izobaryczne i selektywność steryczną
Znaki towarowe
Biozen, Kinetex i Luna są znakami towarowymi firmy Phenomenex.


