Astuce technique HPLC/UHPLC
Niveau : débutant
L’importance d’une phase mobile bien préparée
Un tampon est une solution AQUEUSE contenant un acide faible et sa base conjuguée (ou une base faible et son acide conjugué). Le pH d’une solution tampon change très peu lorsqu'on lui ajoute une petite quantité d’acide fort ou de base forte et peut contribuer à réduire les changements des conditions d'une méthode analytique dans le cas de petites variations des facteurs environnementaux. Les solutions tampons sont utilisées pour maintenir le pH à une valeur presque constante. Elles sont résistantes aux changements de pH grâce à l’équilibre entre cet acide faible (HA) et sa base conjuguée (B).
HA ⇌H^++A^-
(acide) ⇌ (ion hydrogène) + (base conjuguée)
Comment fonctionne un tampon
Lorsqu’on ajoute de l’acide fort (plusieurs H+) à un mélange en équilibre d’un acide faible et sa base conjuguée, l’équilibre est déplacé vers la gauche, selon le principe de Le Chatelier. De la même manière, si l’on ajoute une base forte au mélange, la concentration de l’ion hydrogène diminue moins que la quantité attendue par rapport à la quantité de base ajoutée.
Il y a quelques lignes directrices générales pour la préparation d’un tampon :
- Étalonnez le pH-mètre, idéalement à des valeurs de pH supérieures et inférieures à l'objectif fixé pour votre tampon. Vous pouvez également acheter des solutions tampons calibrées à cette fin.
- Pesez le sel tampon pour obtenir la concentration tampon souhaitée
- Ajoutez le sel à la fiole jaugée contenant de l'eau de grade HPLC et mélangez soigneusement pour le dissoudre.
- Mesurez le pH de la solution à l’aide d'une sonde de pH et d'un pH-mètre.
- Ajustez la valeur du pH jusqu’à obtenir la valeur souhaitée en ajoutant des petits volumes d’acide fort/de base forte.
- Une fois que vous avez obtenu la bonne valeur du pH, diluez la solution jusqu'au volume final souhaité et mélangez bien.
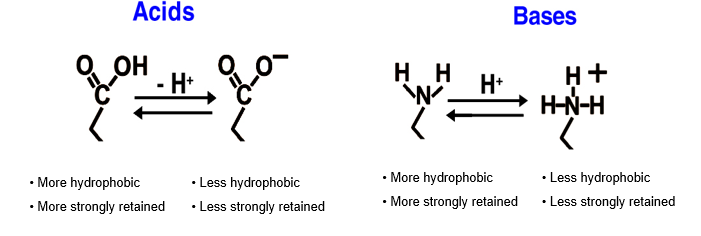
En HPLC, les tampons sont typiquement utilisés pour contrôler les interactions secondaires qui sont généralement considérées comme "non désirées" en chromatographie. Ils sont également utilisés pour contrôler l’état d’ionisation de l’analyte pour s’assurer qu'il n'est pas présent dans plus d'un état ionisé. Le pKa d’un composé indique le pH auquel il est ionisée à 50 % et neutre à 50%. Si vous utilisez ce pH pour vos analyses vous observerez des pics divisés et des temps de rétention variables. Il faut essayer de travailler au moins à deux unités de pH du pKa de l’analyte cible lors du développement d’une méthode.
Fig 1.
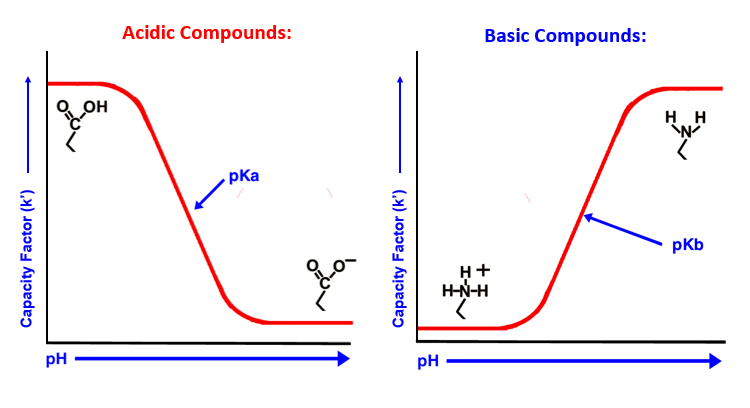
Fig. 2
Lors de la préparation des phases mobiles isocratiques, il y a quelques considérations à prendre en compte pour assurer une bonne robustesse de la méthode :
- Pré-mélangez votre phase mobile si possible, cela éliminera les erreurs au niveau de la pompe.
- Utilisez toujours la même méthode de préparation ; par exemple si vous ajoutez l'eau en premier, vous devez toujours l’ajouter en premier. Ne modifiez pas ce procédé, car les résultats peuvent varier considérablement en termes de temps de rétention de l’analyte.
Vous trouvez ci-dessous une étude qui montre cette variabilité lorsque les phases mobiles étaient mélangés de la façon suivante :
- Eau en premier : 400 ml d’eau dans une éprouvette graduée, ajouter dans une fiole jaugée de 1 litre puis diluer jusqu’au trait de jauge avec du MeOH.
- MeOH en premier : 600 ml de MeOH dans une éprouvette graduée, ajouter dans une fiole jaugée de 1 litre, jusqu’au trait de jauge avec de l’eau.
- MeOH et l’eau mesurés individuellement : 600 ml de MeOH dans une éprouvette graduée, transférer vers un réservoir pour phase mobile ; 400 ml d’eau dans une éprouvette graduée, transférer vers un réservoir pour phase mobile.
- Mélanger A = Eau avec B = MeOH avec la pompe.
Fig. 3
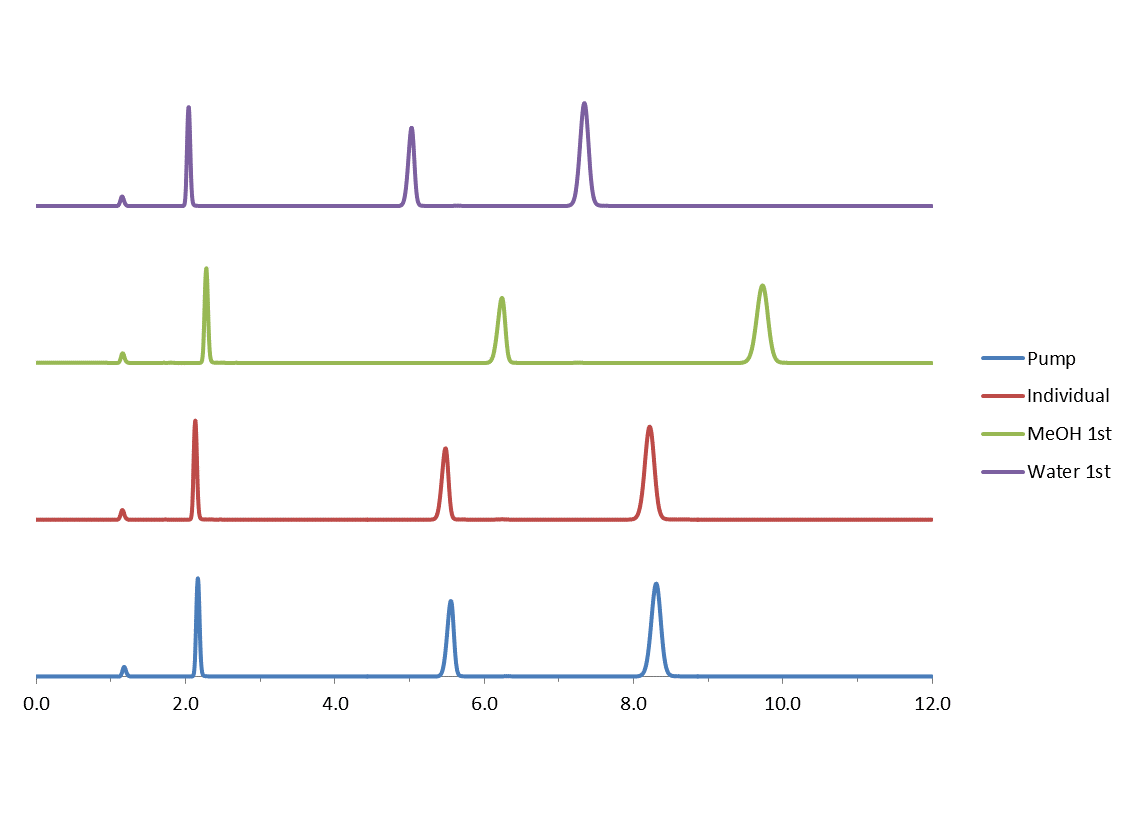
Kinetex™ 5μm XB-C18 150 x 4,6mm; 60:40 MeOH: H20
Débit 1,25ml/min
Volume d’injection 2µl
La concentration de tampon est également importante ; il est généralement considéré que des concentrations inferieures à 10mM ne fournissent pas la capacité tampon qui est nécessaire pour contrôler l’activité du silanol ou l’état de ionisation d’un composé et que 10mM est la concentration minimale efficace pour l’analyse en phase inverse et l’HILIC. Dans le cas d’autre techniques comme l'exclusion stérique, des concentrations sensiblement plus élevées sont nécessaires et il n'est pas rare de voir des excès de concentration de 100mM pour ces méthodes. La concentration du tampon doit être soigneusement équilibrée pour assurer la solubilité dans toutes les conditions. Lors d’une analyse en phase inverse, vous pourriez avoir besoin de limiter la concentration du tampon que vous utilisez si la méthode contient des niveaux élevés de matières organiques (par exemple à travers un gradient) pour vous assurer qu'il n'y ait pas de précipitations dans la zone tampon.
La phase mobile contribue autant à la sélectivité que votre phase stationnaire. Le soin dans la sélection et la préparation est autant important que les tests de lots de la phase stationnaire lors du développement d’une méthode HPLC robuste.


