Astuces techniques sur la préparation d’échantillon
Niveau : débutant
Préparation d'échantillons pour la cartographie peptidique - Bonnes pratiques pour les digestions trypsiques
Dans le cas des biothérapies et des biosimilaires, les organismes de réglementation ont des exigences de caractérisation qui sont principalement axées sur les propriétés physicochimiques des produits thérapeutiques qui affectent l'efficacité, la sécurité et l'immunogénicité. La chromatographie joue un rôle important dans trois domaines spécifiques de l'analyse des propriétés physico-chimiques, à savoir la structure d'ordre supérieur, la structure primaire et les modifications post-traductionnelles. Une technique clé pour déterminer la structure primaire est la cartographie peptidique, qui implique généralement la digestion de la protéine purifiée ou isolée par une protéase à sérine , suivie d'une analyse HPLC. La protéase la plus courante pour ces types de digestion est la trypsine, mais même à l'étape de la digestion, il existe de nombreuses pratiques importantes que nous pouvons utiliser pour améliorer le résultat, et elles seront traitées dans l'astuce technique ci-dessous.
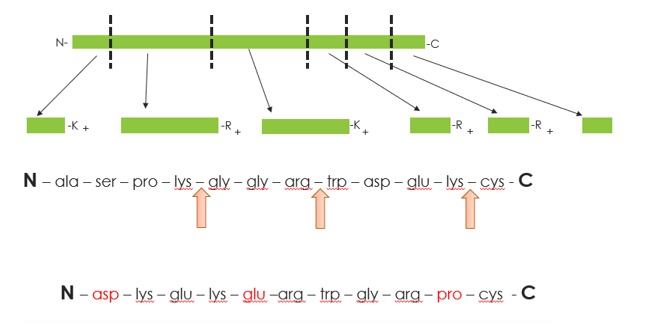
La plupart des digestions de protéines sont effectuées à l'aide de trypsine en raison de sa spécificité bien définie. La trypsine n'hydrolyse que les liaisons peptidiques dans lesquelles le groupe carbonyle est suivi d'un résidu arginine (Arg) ou lysine (Lys), avec les exceptions notables suivantes : lorsque Lys et Arg sont liés par le N à des acides aminés chargés négativement, ou si la proline (Pro) est positionnée sur l'extrémité C terminale de Lys ou Arg.
La trypsine est également favorisée car les peptides résultants ont des résidus basiques à l'extrémité C-terminale, ce qui les rend plus faciles à ioniser par spectrométrie de masse, qui est généralement la méthode de détection préférée pour ces applications. Un dernier avantage de l'utilisation de la trypsine est la gamme de masse des peptides résultants, qui se situe généralement entre 600 et 4 000 Da, ce qui est idéal pour une analyse ultérieure lors de l'utilisation de la LC/UV ou la LC MS/MS.
La digestion trypsique comprend un certain nombre d'étapes ; quelques points clés du processus sont résumés ci-dessous :
Dénaturation et réduction : Il faut utiliser un chaotrope pour déplier complètement la protéine de manière à la rendre accessible à la trypsine ; l'urée ou la guanidine sont couramment utilisées. L'urée est connue pour réduire la couverture de la séquence car elle peut décomposer et ensuite carbamyler à la fois les lysines et les cystéines. Pour cette raison, certains laboratoires ne l'utilisent pas. Le réactif le plus facile à utiliser pour la dénaturation est l'hydrochlorure de guanidine (GnHCl), mais il doit être éliminé par échange de tampon avant la digestion, car il inhibe la trypsine.
Alkylation : Il y a deux agents alkylants courants, l'iodoacétamide (IAM) et l'acide iodoacétique (IAA). L'IAM est le plus courant car il réagit rapidement, mais l'IAA est également utilisé, car il présente un niveau inférieur d'alkylation non spécifique. Avec ces deux agents alkylants, l'ajout de dithiothréitol (DTT) permettra également d'éviter une nouvelle alkylation non spécifique.
Echange de tampons : Après l'alkylation, il est essentiel d'éliminer les réactifs alkylants résiduels ainsi que tout composant dénaturant avant la digestion. Il existe trois approches principales pour ce type de nettoyage d'échantillons : la dialyse, les filtres à centrifuger à seuil de poids moléculaire et les colonnes de dessalement. La dialyse entraîne de longs temps de nettoyage, mais aussi une faible perte d'échantillon. Les filtres à centrifuger et les colonnes de dessalement sont susceptibles de perdre un partie de l'échantillon, mais ils fournissent une méthode plus rapide de nettoyage que la dialyse.
Digestion : Nous examinons ici les considérations relatives à la digestion à l'aide de la trypsine. Les peptides trypsiques peuvent être relativement courts, et il est également possible que des clivages soient manqués. La trypsine porcine est la plus couramment utilisée pour la digestion ; cette enzyme a une préférence pour l'Arg avec une efficacité moindre pour la Lys. Parmi les autres clivages manqués, on trouve Asp ou Glu à côté de Lys ou Arg sur l'extrémité C, ainsi que Proline (Pro) sur l'extrémité N. La trypsine ne peut couvrir qu'une partie limitée du protéome ; dans de nombreux cas, des protéases parallèles doivent également être utilisées, y compris AspN ou GluC, pour obtenir une couverture complète de la séquence.
Lorsque la couverture des séquences est fondamentale, on peut utiliser des protéases orthogonales, qui sont résumées ci-dessous.
| Enzyme | Site de clivage | Avantage | Limitations |
|---|---|---|---|
| ArgC | C-terminal de R | Augmenter la couverture protéomique de manière qualitative | Fragments de peptides plus grands que la trypsine |
| AspN | N-terminal de D | Large gamme de pH | Fragments de peptides plus grands que la trypsine. Des clivages manqués sont possibles |
| Chymotrypsine | C-terminal de F, Y, L, W | Espace protéomique orthogonal à la trypsine | Non spécifique pour les peptides hydrophobes entraînant des clivages manqués |
| GluC | C-terminal de D | Augmenter la couverture protéomique de manière qualitative | Fragments de peptides plus grands que la trypsine |
| LysC | C-terminal de K | Complète la trypsine | Chevauchement avec la trypsine, donc pas une protéase orthogonale idéale |
| Pepsin | C-terminal de Y F W | Activité élevée à faible pH utilisée pour la HDX-MS | Spectres complexes résultants |
Vous trouverez ci-dessous un résumé du type de restrictions de paramètres à respecter lors de la digestion des protéines avec la trypsine.
| Paramètre | Gamme | Exemple | Considérations |
|---|---|---|---|
| Rapport enzyme substrat | 1:5 – 1:50 | 1:20 | Optimiser la durée et la température de la digestion |
| Température (°C) | 37-90 | 56 | Flux de travail Désamidation au-dessus de 37 °C |
| Durée de la digestion (heures) | 2-16 | 4 | Fin de la digestion ; Activité non liée à la trypsine ; Autoclivage de la trypsine |
| pH | 7.5-8.2 | 7.6 | Désamidation à un pH > 7,5 ; Activité optimale de la trypsine |
| Supplément de protéase | n/a | LysC | Fin de la digestion |
En conclusion, ce n'est pas toujours la méthode d'analyse ou l'analyse HPLC qui dicte entièrement la couverture de la séquence lorsqu'on examine la structure primaire d'une protéine. Les étapes et les précautions prises lors de la préparation de l'échantillon peuvent également jouer un rôle essentiel, et certaines d'entre elles sont résumées ci-dessus. Lorsque des étapes appropriées sont franchies dans la digestion de la protéine, l'analyse HPLC ou LC/MS devient un processus beaucoup plus facile pour garantir l'obtention d'une couverture adéquate.
DÉCOUVREZ PhenoAcademy
Une série de webinaires éducatifs GRATUITS, destinée aux scientifiques afin d'améliorer leurs compétences en chromatographie.



