Wskazówka techniczna dotycząca przygotowania próbki
Poziom: Średnio zaawansowany
Przygotowanie próbek do mapowania peptydowego - dobre praktyki dotyczące trawienia tryptycznego
W świecie bioterapeutyków i leków biopodobnych agencje regulacyjne mają wymagania dotyczące chrakteryzacji, które koncentrują się głównie na właściwościach fizykochemicznych środków terapeutycznych, które wpływają na skuteczność, bezpieczeństwo i immunogenność. Chromatografia odgrywa ważną rolę w trzech konkretnych obszarach analizy właściwości fizykochemicznych, takich jak struktura wyższego rzędu, struktura pierwotna i modyfikacje potranslacyjne. Jedną z kluczowych technik określania struktury pierwotnej jest mapowanie peptydów, które zazwyczaj obejmuje trawienie proteazą serynową oczyszczonego lub wyizolowanego białka, a następnie analizę przy użyciu HPLC. Najpopularniejszą proteazą do tego typu trawienia jest trypsyna, jednak nawet na etapie trawienia istnieje wiele ważnych praktyk, które możemy zastosować w celu poprawy wyników, a zostaną one omówione w poniższej wskazówce technicznej.
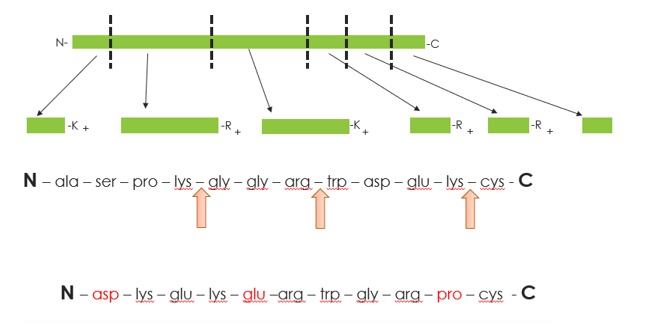
Większość trawień białek przeprowadza się przy użyciu trypsyny ze względu na jej dobrze zdefiniowaną specyficzność. Trypsyna hydrolizuje tylko wiązania peptydowe, w których po grupie karbonylowej następuje reszta argininy (Arg) lub lizyny (Lys), z następującymi godnymi uwagi wyjątkami: gdy Lys i Arg są N-związane z ujemnie naładowanymi aminokwasami lub gdy prolina (Pro) znajduje się na C-końcu obok Lys lub Arg.
Trypsyna jest również preferowana, ponieważ powstałe peptydy mają zasadowe reszty na C-końcu, co ułatwia ich jonizację za pomocą spektrometru mas, co jest zwykle preferowaną metodą wykrywania w tych zastosowaniach. Ostatnią zaletą stosowania trypsyny jest zakres mas powstających peptydów, który zwykle wynosi od 600 do 4000 Da, co jest idealne do późniejszej analizy przy użyciu LC/UV LC MS/MS.
Podstawowe trawienie tryptyczne składa się z szeregu etapów, dla których kilka kluczowych punktów procesu podsumowano poniżej:
Denaturacja i redukcja: Chaotrop jest niezbędny do całkowitego rozwinięcia białka, tak aby było ono dostępne dla trypsyny, do czego powszechnie stosuje się mocznik lub guanidynę. Wiadomo, że mocznik zmniejsza pokrycie sekwencji, ponieważ może rozkładać, a następnie karbamylować zarówno lizyny, jak i cysteiny, dlatego w niektórych laboratoriach będzie się go unikać. Najłatwiejszym odczynnikiem do denaturacji jest chlorowodorek guanidyny (GnHCl), jednak musi on zostać usunięty poprzez wymianę buforu przed trawieniem, ponieważ hamuje trypsynę.
Alkilacja: Istnieją dwa powszechnie stosowane środki alkilujące: jodoacetamid (IAM) i kwas jodooctowy (IAA). IAM jest najbardziej powszechny, ponieważ reaguje szybko, jednak IAA jest również używany, ponieważ wykazuje mniej niespecyficzną alkilację. W przypadku obu odczynników dodanie ditiotreitolu (DTT) pomoże również zapobiec dalszej niespecyficznej alkilacji.
Wymiana buforów: Po alkilacji konieczne jest usunięcie pozostałości odczynników alkilujących, a także wszelkich składników denaturujących przed trawieniem. Istnieją trzy główne podejścia do tego typu oczyszczania próbek: dializa, filtry odcinające masę i kolumny odsalające. Dializa prowadzi do długiego czasu oczyszczania, ale utrata próbki jest bardzo niewielka. Filtry i kolumny odsalające są podatne na straty, ale oferują szybszą metodę oczyszczania próbek niż dializa.
Trawienie: W tym miejscu przyjrzymy się rozważaniom dotyczącym trawienia przy użyciu trypsyny. Peptydy tryptyczne mogą być stosunkowo krótkie, a także istnieje możliwość wystąpienia pominiętych rozszczepień. Trypsyna świńska jest najczęściej stosowana do trawienia, a enzym ten preferuje Arg, z niższą wydajnością dla Lys. Inne pominięte rozszczepienia obejmują Asp lub Glu obok Lys lub Arg na C-końcu, a także Proline (Pro) na N-końcu. Sama trypsyna może pokryć tylko ograniczoną część proteomu, dlatego należy również stosować równoległe proteazy, w tym AspN lub GluC w wielu przypadkach w celu pełnego pokrycia sekwencji.
Gdy pokrycie sekwencji jest krytyczne, można zastosować proteazy ortogonalne, które podsumowano poniżej.
| Enzym | Miejsce rozszczepienia | Korzyści | Ograniczenia |
|---|---|---|---|
| ArgC | C-koniec R | Jakościowe zwiększenie pokrycia proteomu | Większe fragmenty peptydów niż trypsyna |
| AspN | N-koniec D | Szeroki zakres pH | Większe fragmenty peptydów niż trypsyna. Możliwe są pominięte rozszczepienia |
| Chymotrypsyna | C-koniec F, Y, L, W | Ortogonalna przestrzeń proteomu dla trypsyny | Niespecyficzny dla hydrofobowych peptydów, co skutkuje nieudanymi rozszczepieniami |
| GluC | C-koniec D | Jakościowe zwiększenie pokrycia proteomu | Większe fragmenty peptydów niż trypsyna |
| LysC | C-koniec K | Uzupełnia trypsynę | Pokrywa się z trypsyną, więc nie jest świetną proteazą ortogonalną |
| Pepsyna | C-koniec Y F W | Wysoka aktywność przy niskim pH stosowana w HDX-MS | Skomplikowane widma |
Poniżej znajduje się podsumowanie ograniczeń parametrów, których należy przestrzegać podczas trawienia białek trypsyną.
| Parametr | Zakres | Przykład | Rozważania |
|---|---|---|---|
| Stosunek enzymu do substratu | 1:5 – 1:50 | 1:20 | Optymalizacja długości i temperatury trawienia |
| Temperatura (°C) | 37-90 | 56 | Wydajność deamidacja powyżej 37 °C |
| Długość trawienia (godziny) | 2-16 | 4 | Zakończenie trawienia Aktywność inna niż trypsyny |
| pH | 7.5-8.2 | 7.6 | Deamidacja przy pH > 7,5 Optymalna aktywność trypsyny |
| Suplementacja proteaz | n/a | LysC | Zakończenie trawienia |
Podsumowując, nie zawsze metoda analityczna lub analiza HPLC w pełni dyktuje pokrycie sekwencji podczas badania pierwotnej struktury białka. Kroki i środki ostrożności podjęte podczas przygotowywania próbek mogą również odgrywać istotną rolę, a niektóre z nich zostały podsumowane powyżej. W przypadku podjęcia odpowiednich kroków w trawieniu białka, późniejsza analiza HPLC lub LCMS staje się znacznie łatwiejszym procesem zapewniającym odpowiednie pokrycie.
Odkryj PhenoAcademy
PhenoAcademy to BEZPŁATNY praktyczny program edukacyjny z webinariami krok po kroku, mający na celu poszerzenie wiedzy na temat chromatografii oraz opanowanie umiejętności badawczych i rozwiązywania problemów!



