Suggerimento tecnico HPLC/UHPLC
Livello: Base
L'importanza della preparazione della fase mobile
Un tampone è una soluzione ACQUOSA contenente un acido debole e la sua base coniugata (oppure una base debole e il suo acido coniugato). Il pH di una soluzione tampone subisce piccole variazioni in seguito all'aggiunta di basse quantità di acido o base forte; difatto mitigando i cambiamenti al metodo analitico legate alla variazione di fattori ambientali. Le soluzioni tampone vengono utilizzate per mantenere il pH a un valore quasi costante. Le piccole variazioni di pH sono dovuti della presenza di un equilibrio tra l'acido debole (HA) e la sua base coniugata (B).
HA ⇌H^++A^-
(acido) ⇌ (ione idrogeno) + (base coniugata)
Come Funziona un Buffer
Quando un acido forte viene aggiunto ad una miscela di equilibrio dell'acido debole e della sua base coniugata, l'equilibrio viene spostato a sinistra, secondo il principio di Le Chatelier. Allo stesso modo, se alla miscela viene aggiunta una base forte, la concentrazione di ioni idrogeno diminuisce di meno della quantità prevista per la quantità di base aggiunta.
Quando si prepara un buffer, è necessario attenersi ad alcune linee guida generali:
- Calibrare il misuratore di pH; idealmente a valori di pH superiori e inferiori rispetto a quello del buffer. Esistono soluzioni tampone a pH noto (certificate, vendute a questo scopo);
- Pesare il sale del tampone necessario ad ottenere la concentrazione finale desiderata;
- Aggiungere il sale pesato al matraccio contenente acqua di grado HPLC e mescolare accuratamente affinchè il sale si sciolga perfettamente;
- Utilizzando una sonda per pH e un pHmetro, misurare il pH della soluzione;
- Regolare il pH al valore desiderato mediante aggiunte di piccoli volumi di acido forte e/o base forte;
- Una volta che il pH è corretto, diluire la soluzione al volume finale desiderato e mescolare bene.
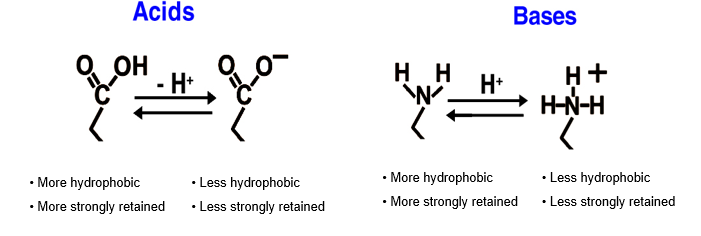
In HPLC, i tamponi sono utilizzati per controllare le interazioni secondarie "indesiderate", ma sono anche usati per controllare lo stato di ionizzazione dell'analita e assicurarsi che quest'ultimo non sia presente in più di uno stato di carica. Il pKa è il logaritmo in base 10 negativo della costante di dissociazione acida (Ka ) di una soluzione,più basso è il valore di pKa e più forte è l'acido. Secondo l'equazione HA=H+ + A-, il pKa dell'analita analita è il pH a cui [HA]neutra=[A-]negativa, per cui alla pKa la carica media dell'analita è negativa. Se si lavora ad un pH pari al pKa, è possibile osservare picchi sdoppiati e tempi di ritenzione variabili se l'equilibrio è condizionato da fattori cinetici, ovvero è lento. Tutti i metodi dovrebbero essere sviluppati a 2 unità dal pKa.
Figura 1
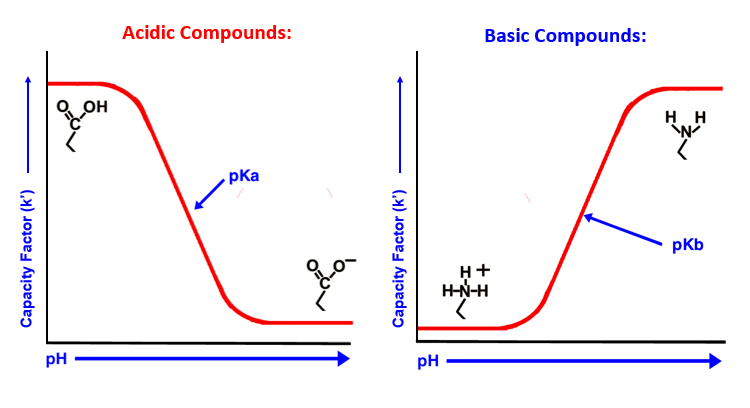
Figura 2
Quando si prepara una fase mobile per analisi in isocratica, ci sono alcune considerazioni da fare per aumentare la robustezzza del metodo:
- In particolare, va ricordato che non si deve portare a volume con miscele di solventi in quanto il volume non è additivo e che pre-miscelare la fase mobile, dove possibile, è la procedura migliore per eliminerare l'errore dovuto alla pompa.
- Utilizzare sempre lo stesso metodo per la preparazione; ad esempio, se aggiungi prima l'acqua, dovresti sempre aggiungerla prima. Se si misurano i singoli componenti e quindi si mescola, è sempre necessario farlo in questo modo. Non modificare questo processo in quanto i risultati possono variare in modo significativo, influenzando i tempi di ritenzione.
Di seguito è riportato un esperimento che mostra questa variabilità quando le fasi mobili sono state mescolate nei seguenti modi:
- Prima l'acqua: Trasferisci in un matraccio 400 mL di acqua, misurata con un cilindro graduato, e aggiungi MeOH fino a 1 litro.
- Prima MeOH:Trasferisci in un matraccio 600 mL di MeOH, misurata con un cilindro graduato, e aggiungi Acqua fino a 1 litro.
- MeOH e Acqua misurati singolarmente: Tasferisci in una bottiglia per HPLC 600 mL di MeOH misurata con un cilindro graduato e aggiungi 400 mL di Acqua misurata con lo stesso cilindro graduato.
- Lasciare miscelare la pompa A = Acqua con B = MeOH .
Figura 3
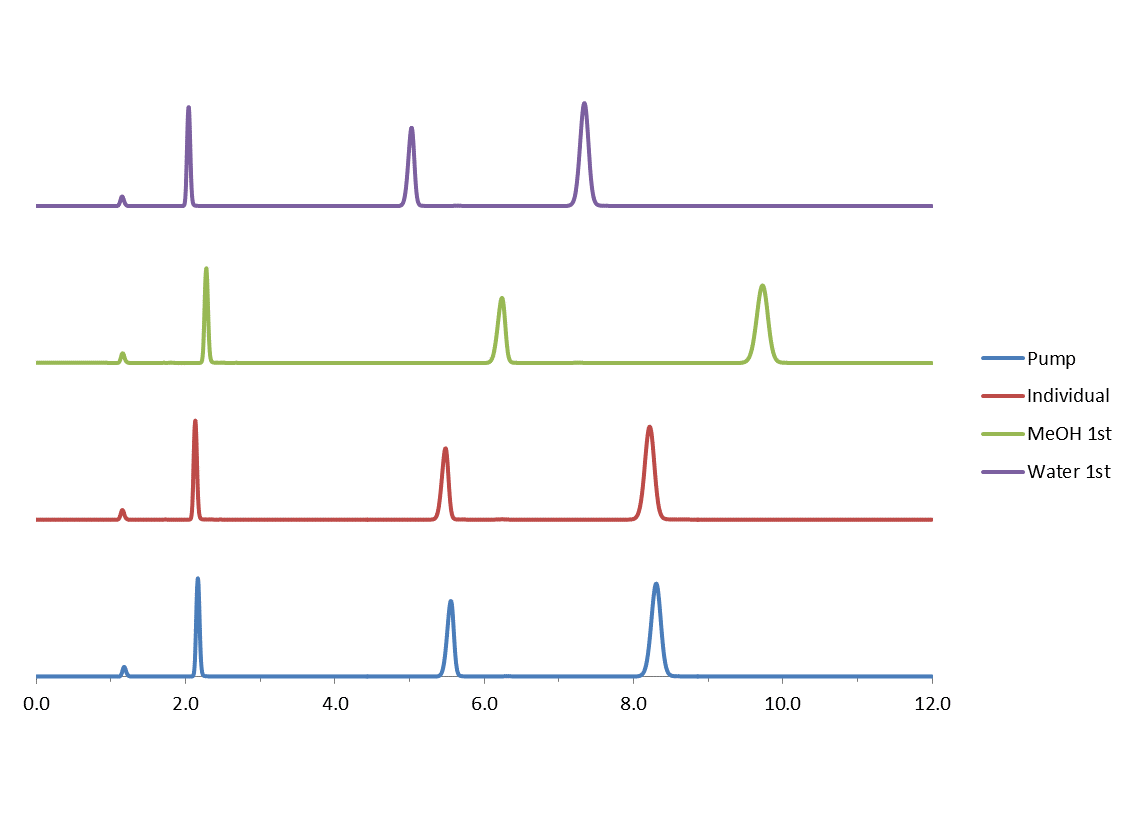
Kinetex™ 5μm XB-C18 150 x 4.6mm; 60:40 MeOH: H20
Flow rate 1.25mL/min
Inj Vol 2µL
Anche le concentrazioni tampone sono importanti, si ritiene generalmente che concentrazioni inferiori a 10 mM non offrano la capacità tampone necessaria a controllare l'attività dei silanoli, o lo stato di ionizzazione di un composto e 10mM sarebbe considerata la concentrazione minima effettiva per la fase inversa e l'HILIC. Per altre tecniche come l'esclusione delle dimensioni, sono necessarie concentrazioni significativamente più elevate e non è raro vedere concentrazioni superiori a 100 mM per questi metodi. La concentrazione tampone è qualcosa che deve essere attentamente bilanciato per garantire la solubilità in tutte le condizioni. Quando si lavora in condizioni di fase inversa, potrebbe essere necessario limitare la concentrazione del buffer con cui si sta lavorando se il metodo contiene alti livelli di organico per garantire che non si verifichi alcuna precipitazione del buffer.
La fase mobile gioca un ruolo importante alla selettività quanto la fase stazionaria; la cura con cui si sceglie e si prepara è importante quanto le fasi stazionaria quando si sviluppano metodi robusti in HPLC.


