Wskazówki techniczne HPLC / UHPLC
Poziom: Średnio zaawansowany
Jak współczynnik retencji wpływa na niezawodność metody?
Patrząc na dane wygenerowane z analizy HPLC, naturalne jest skupienie się na czasie retencji, asymetrii piku i sprawności. Parametry te pozwolą użytkownikowi zidentyfikować i określić ilościowo anality: im bardziej precyzyjne są te informacje, tym większa pewność co do tożsamości piku i stężenia analitu.
Współczynnik retencji jest często pomijanym parametrem separacji, ale prawidłowo wykorzystany może pomóc użytkownikowi w opracowaniu bardziej niezawodnej metodologii. Współczynnik retencji służy do normalizacji czasu retencji analitu względem wymiarów kolumny analitycznej i jest zdefiniowany jako:
K’ = tr - t0/t0
Gdzie tr jest czasem retencji analitu, a t0 czasem retencji niezatrzymanego związku.
Znaczenie współczynnika retencji można najlepiej zilustrować na przykładzie:
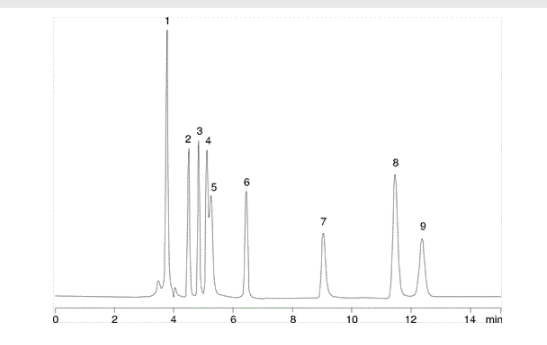
1. Kwas szczawiowy
2. Kwas winowy
3. Kwas glikolowy
4. Kwas mrówkowy
5. Kwas pirogronowy
6. Kwas malonowy
7. Kwas octowy
8. Kwas maleinowy
9. Kwas cytrynowy
W tym przypadku mamy do czynienia z separacją kwasów organicznych, prowadzoną na kolumnie C18, która jest stabilna w 100% warunkach wodnych. Faza ruchoma to 20 mM bufor fosforanu potasu o pH 2,9, z szybkością przepływu 0,7 ml/min. Na pierwszy rzut oka kwas szczawiowy jest zatrzymywany przez prawie 4 minuty, ale po dokładniejszym przyjrzeniu się t0 dla tej kolumny wynosi około 3,7 minuty. Biorąc to pod uwagę, jasne jest, że kwas szczawiowy, bardzo polarny dikwas, jest ledwo zatrzymywany przez kolumnę.
K’ = 3.9 - 3.7/3.7 = 0.054
Wynika to z faktu, że kwas szczawiowy prawie nie wiąże się z fazą stacjonarną podczas analizy. W takich przypadkach na retencję analitu duży wpływ będą miały niewielkie, niezamierzone zmiany parametrów, w tym:
• Skład fazy ruchomej
• pH fazy ruchomej
• Moc rozpuszczalnika próbki
• Temperatura
Jest zatem mało prawdopodobne, aby taka metoda była niezawodna, ponieważ czas retencji kwasu szczawiowego może się różnić z nastrzyku na nastrzyk, z kolumny na kolumnę czy w wyniku zmian w składzie fazy ruchomej.
Zaleca się, aby przy opracowywaniu metod współczynniki retencji mieściły się w zakresie 2-10 dla wszystkich analitów. Widzieliśmy potencjalne problemy ze współczynnikami retencji mniejszymi niż 2, ale dlaczego zatrzymywać się na współczynniku retencji wynoszącym 10?
Podczas przebiegu izokratycznego szerokość piku zwiększa się wraz ze wzrostem czasu retencji z powodu dyfuzji. Chociaż zastosowanie kolumn o mniejszym wypełnieniu w połączeniu z optymalną szybkością przepływu pomoże zmniejszyć tę dyfuzję, nie można jej wyeliminować. Ponadto, wysokie współczynniki retencji ostatecznie skutkują długimi czasami pracy, które są ogólnie niepożądane ze względu na spadek wydajności.
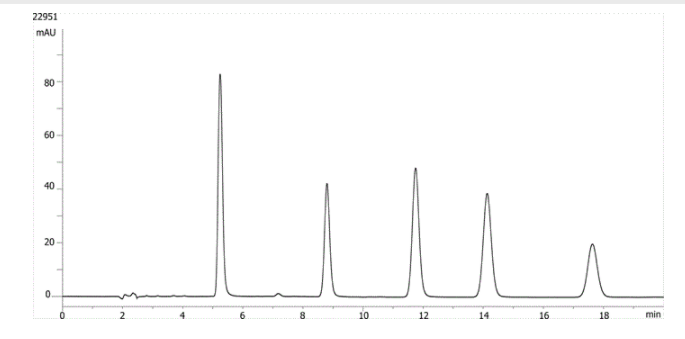
1. Hydrokortyzon
2. Kortykosteron
3. 11-a-hydroksyprogesteron
4. Octan kortyzonu
5. 11-Ketoprogesteron
Tutaj mamy przykład analizy sterydów prowadzonych na kolumnie 150 x 4,6 mm z prędkością 1 ml/min. 11-ketoprogesteron eluuje po około 17,5 minutach, przy współczynniku retencji około 10,6. W tym izokratycznym przebiegu widoczne jest poszerzenie piku, co wskazuje, że ostatni eluujący pik jest zatrzymywany na kolumnie przez zbyt długi czas.
Zrozumienie wytycznych (współczynniki retencji między 2 a 10) jest pomocne, ale pozostawia nas z pytaniem, jak można je dostosować?
Współczynnik retencji jest odwrotnie proporcjonalny do siły elutropowej fazy ruchomej. Wyższa siła elutropowa obniży współczynnik retencji i odwrotnie. W sytuacji gdy niskich współczynników retencji nie można zwiększyć poprzez zmniejszenie siły elutropowej fazy ruchomej, może być konieczne przejście na fazę stacjonarną, która może zapewnić większą retencję analitów, na przykład poprzez zastosowanie bardziej polarnej fazy stacjonarnej dla polarnych analitów.


