Wskazówki techniczne HPLC / UHPLC
Poziom: Podstawowy
Wpływ gradientu na pojemność buforową
Gradient w HPLC jest fantastycznym sposobem na analizę próbki, w szczególności gdy anality wykazują szeroki zakres oddziaływań z fazą stacjonarną preferowanej kolumny. Metoda gradientowa nie zawsze jest łatwa do wprowadzenia w kontekście buforów, gdyż konieczne jest utrzymanie określonego pH. Jeśli bufor jest przygotowany wyłącznie w wodnej części fazy ruchomej, podczas gdy organiczna część fazy ruchomej pozostaje wyłącznie rozpuszczalnikiem organicznym, gradient jest podatny na ograniczenia rozpuszczalności i niestabilną siłę buforowania, w miarę wzrostu stosunku rozpuszczalnika organicznego podczas gradientu. Można temu zaradzić, stosując równomierne umieszczenie buforu zarówno w "słabej", jak i "silnej" fazie ruchomej w danej metodzie. Przeanalizujemy kilka podejść i przykładów.
Dodatek zarówno do "słabej", jak i "silnej" fazy ruchomej kwaśnego lub zasadowego dodatku, takiego jak kwas mrówkowy (HCO2H) w stężeniu 0,1% (v/v)?
Obecność w obu częściach fazy ruchomej idealnie utrzyma stały poziom dodatku w całej fazie ruchomej, zmianie ulegnie zawartość części organicznej, a nie samego dodatku do fazy. Wadą takiego rozwiązania jest to, że dodatek może być podatny na ulatnianie się z części fazy ruchomej, jednocześnie wywołując niespójne siły protonowania lub deprotonowania w stosunku do analitów. Nie ukrywajmy, że niektórym z nas przydarza się, że nie zbyt precyzyjnie przygotowujemy fazy (v/v) ze względu na pośpiech lub inny czynnik zewnętrzny. Właściwy bufor z odpowiednią sprzężoną solą precyzyjnie utrzyma stałe pH, przy którym jest przygotowywany, bez ryzyka ulatniania się dodatku.
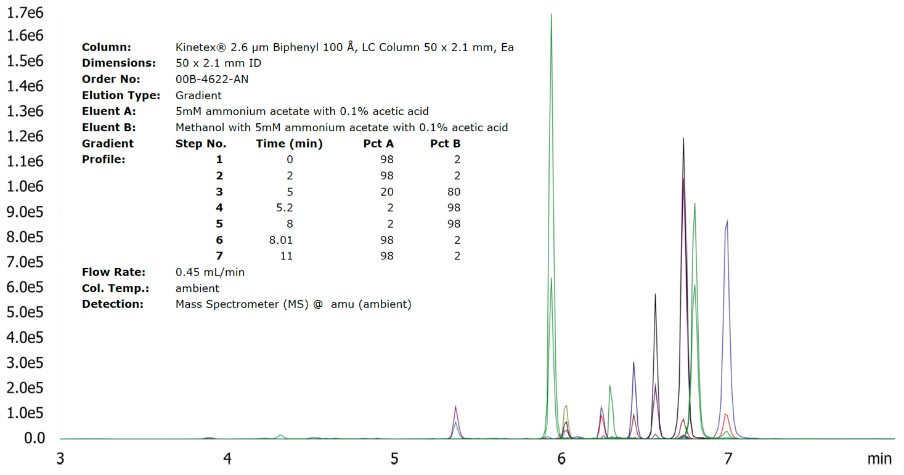
Bufor mrówczanu amonu (NH4HCO2) i octanu amonu (NH4CH3CO2) jest jednymi z najbardziej uniwersalnych rozwiązań dla metod gradientowych, ponieważ ich sole są rozpuszczalne w metanolu, podczas gdy odpowiednie bufory wodne mogą być mieszane w wysokich proporcjach z acetonitrylem. Niezbędna siła buforowania zazwyczaj mieści się w przedziale 5-10 mM w każdej fazie ruchomej, dla porównania metoda izokratyczna 60:40 "20 mM bufor"/acetonitryl, dla której stężenie buforu w stosunku do całej fazy ruchomej wynosi tylko 12 mM. Rysunek 1 przedstawia analizę mikotoksyn na kolumnie Kinetex™ Biphenyl z buforem octanu amonu o stężeniu 5 mM dodanym zarówno do fazy wodnej, jak i organicznej, w której octan amonu rozpuszczono bezpośrednio w metanolu.
Rysunek 2 przedstawia analizę w trybie HILIC wolnych aminokwasów na kolumnie Biozen™ Glycan, gdzie bufor 100 mM mrówczan amonu (pH 3,1) został dodany do wody i acetonitrylu wymieszanych w stosunku 9:1 rozpuszczalnik/bufor. Każda z uzyskanych faz ruchomych miała ogólne stężenie buforu wynoszące 10 mM mrówczanu amonu, co pozwoliło utrzymać stałą siłę buforującą w całym gradiencie.
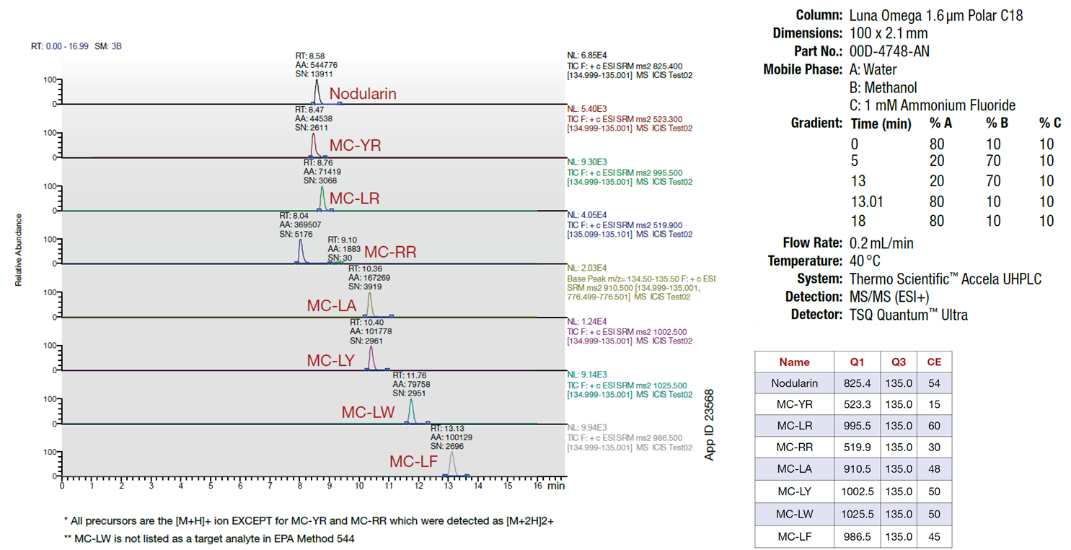
Fluorek amonu (NH4F) jest często dodawany w niewielkich ilościach (0,1 – 0,2 mM) do fazy ruchomej w celu generowania adduktów fluorkowych [M+F]- (dających wysoką czułość) podczas LC/MS w trybie negatywnym ESI, lub w celu zwiększenia generowania jonów [M+H]+ lub [M+NH4]+ w trybie pozytywnym ESI. Rysunek 3 przedstawia zastosowanie trzeciej linii rozpuszczalnika, przez którą wprowadzany jest rozwtór NH4F o stężeniu 1 mM, w proporcji 1:9 do głównej fazy mobilnej, co odpowiada stężeniu 0,1 mM w całej fazie mobilnej w trakcie gradientu. Pompy trójskładnikowe i czteroskładnikowe ułatwiają stworzenie takiej metody, ale zaleca się utrzymanie warunków izokratycznych na początku metody, aby uwzględnić możliwość przenoszenia metody między instrumentami. Gradienty trójskładnikowe i czteroskładnikowe mogą być podatne na objętości martwe systemu, które są specyficzne dla każdego instrumentu i mogą być problemem nawet wtedy, gdy jedna z linii rozpuszczalnika utrzymywana jest na stałym procentowym udziale w ogólnym gradiencie.
Bądź uważny na kwestie rozpuszczalności, gdy próbujesz wprowadzić bufory węglanu amonu lub bufory fosforanowe do metod gradientowych, zwłaszcza pracując z buforami fosforanowymi. Bufory te niosą ryzyko wytrącania się, gdy są mieszane z rozpuszczalnikami organicznymi w dużym ich nadmiarze, dlatego zaleca się przeprowadzenie badania rozpuszczalności. Wreszcie, upewnij się, że dołączysz zamierzony bufor fazy ruchomej jako część roztworu rozcieńczającego próbkę, aby dostosować pH do fazy ruchomej, co wpłynie korzystnie na kształt i powtarzalność otrzymywanych pików. Zastosowanie gradientu, w którym faza ruchoma ma stałą siłę buforowania i wartość pH, ostatecznie poprawi odtwarzalność metody LC.
Znaki towarowe
Kinetex, Biozen i Luna są znakami towarowymi firmy Phenomenex.