Un tampón es una solución ACUOSA que contiene un ácido débil y su base conjugada (o una base débil y su ácido conjugado). El pH de una solución tampón cambia muy poco cuando se le añade una pequeña cantidad de ácido o base fuerte y puede ayudar a anular los cambios condicionantes en un método analítico cuando varían pequeños factores ambientales. Las soluciones tampón se utilizan para mantener el pH en un valor casi constante. Son resistentes al cambio de pH debido a la presencia de un equilibrio entre este ácido débil (HA) y su base conjugada (B).
(ácido) ⇌ (ion hidrógeno) + (base conjugada)
Cómo funciona un tampón
Cuando se añade un ácido fuerte (más H+) a una mezcla en equilibrio del ácido débil y su base conjugada, el equilibrio se desplaza hacia la izquierda, de acuerdo con el principio de Le Chatelier. Del mismo modo, si se añade una base fuerte a la mezcla, la concentración de iones hidrógeno disminuye en una cantidad inferior a la esperada para la cantidad de base añadida.
A la hora de preparar un tampón hay que seguir algunas pautas generales:
- Calibrar el medidor de pH; idealmente con valores de pH por encima y por debajo del objetivo para su preparación de tampón. Existen soluciones tampón calibradas que se venden para este fin.
- Pesar la sal del tampón para obtener la concentración de tampón deseada
- Añadir al matraz aforado que contiene agua de grado HPLC y mezclar bien para que se disuelva
- Usar una sonda de pH y un medidor de pH, medir el pH de la solución
- Ajustar el pH al valor deseado añadiendo pequeños volúmenes de ácido y/o base fuerte
- Una vez que el pH sea correcto, diluir la solución hasta el volumen final deseado y mezclar bien
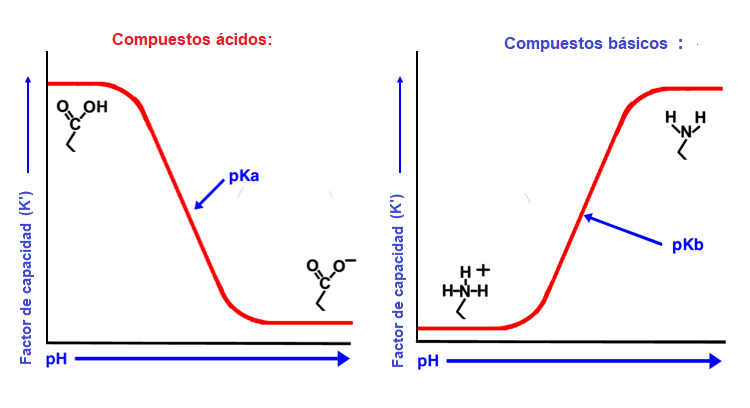
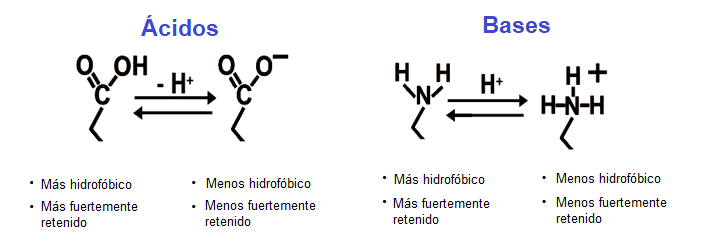
En la HPLC, los tampones se utilizan normalmente para controlar las interacciones secundarias que generalmente se consideran no deseadas" en el mundo de la cromatografía. También se utilizan para controlar el estado de ionización del analito para garantizar que no esté presente en más de un estado ionizado. El pKa de un compuesto presenta el pH al que se encuentra 50% ionizado y 50% neutro. Si se trabaja a este pH se verán picos desdoblados y tiempos de retención variables. Todos los métodos deben esforzarse por trabajar al menos a dos unidades de pH del pKa de su analito objetivo.
Cuando se preparan fases móviles isocráticas hay algunas consideraciones adicionales para asegurar una buena robustez del métodos
- Premezcle su fase móvil siempre que sea posible, esto eliminará el error de la bomba
- Utilice siempre el mismo método de preparación; por ejemplo, si añade primero el agua, debería añadirla siempre en primer lugar. Si mide los componentes individuales y luego los mezcla, debe hacerlo siempre de esta manera. No cambie este proceso, ya que los resultados pueden variar significativamente en cuanto al tiempo de retención del analito.
A continuación se presenta un experimento que muestra esta variabilidad cuando las fases móviles se mezclaron de las siguientes maneras
- Primero el agua: 400 mL de agua en una probeta graduada, añadir al matraz aforado de 1 litro, diluir hasta la marca con MeOH
- Primero el MeOH: 600 mL de MeOH en una probeta graduada, añadir al matraz aforado de 1 litro, diluir hasta la marca con agua
- El MeOH y el agua se miden individualmente: 600 mL de MeOH en la probeta graduada, transferir a la botella de fase móvil; 400 mL de agua en la misma probeta graduada y transferir a la botella de fase móvil
- Dejar que la bomba mezcle A = Agua con B = MeOH.
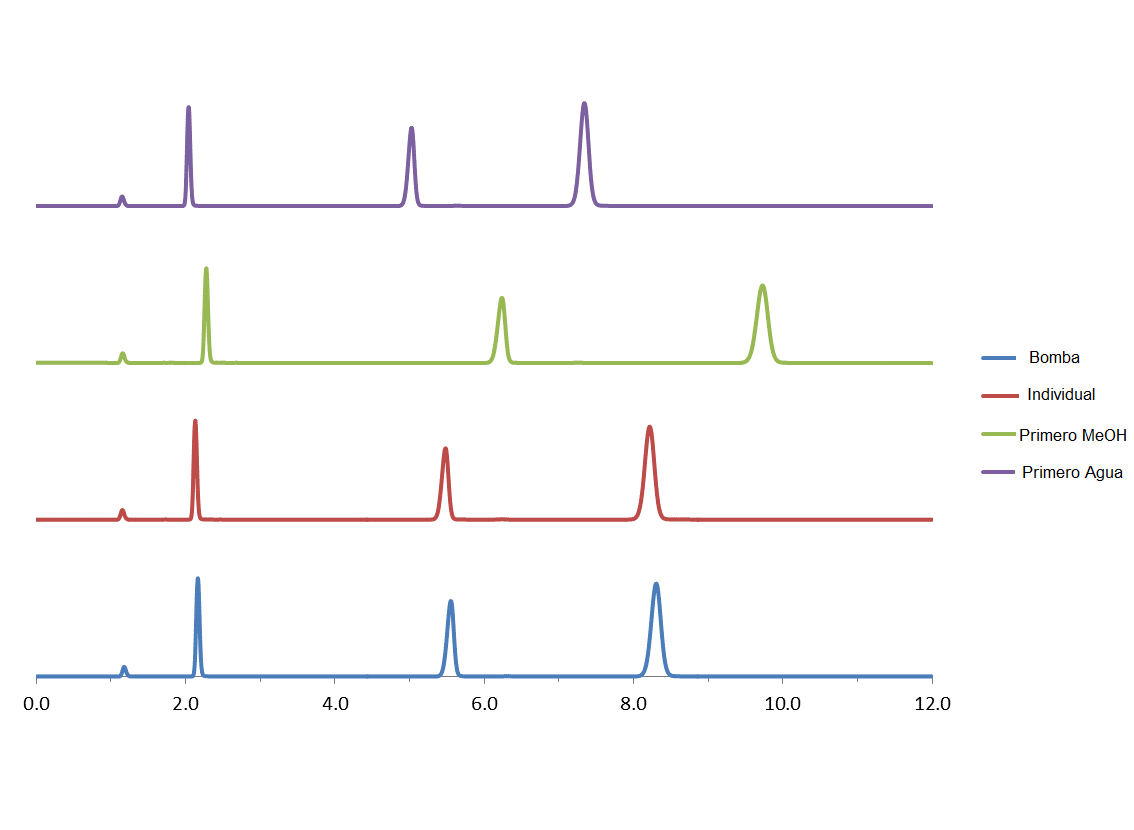
Flujo 1.25mL/min
Inj Vol 2µL
Las concentraciones de tampón también son importantes, en general se considera que las concentraciones inferiores a 10mM no ofrecen la capacidad tampón necesaria para controlar la actividad del silanol, o el estado de ionización de un compuesto y 10mM se consideraría la concentración mínima efectiva para la fase reversa e HILIC. Para otras técnicas, como la exclusión por tamaño, se requieren concentraciones significativamente mayores y no es raro ver concentraciones superiores a 100mM para estos métodos. La concentración del tampón es algo que debe equilibrarse cuidadosamente para garantizar la solubilidad en todas las condiciones. Cuando se trabaja en condiciones de fase reversa, puede ser necesario limitar la concentración del tampón con el que se trabaja si el método contiene altos niveles de orgánicos (por ejemplo a través de un gradiente) para asegurar que no se produce precipitación del tampón.
La fase móvil contribuye a la selectividad tanto como la fase estacionaria y el cuidado en la selección y preparación es tan importante como el ensayo de lotes de fases estacionarias cuando se desarrollan métodos robustos de HPLC.
