Ein Puffer ist eine WÄSSRIGE Lösung, die eine schwache Säure und ihre konjugierte Base (oder eine schwache Base und ihre konjugierte Säure) enthält. Der pH-Wert einer Pufferlösung ändert sich nur sehr geringfügig, wenn ihr eine kleine Menge einer starken Säure oder Base zugesetzt wird. Er kann dazu beitragen, die Bedingungen in einer analytischen Methode zu stabilisieren, wenn kleine Umweltfaktoren variieren. Pufferlösungen werden verwendet, um den pH-Wert auf einem nahezu konstanten Wert zu halten. Sie sind unempfindlich gegen pH-Änderungen, da ein Gleichgewicht zwischen der schwachen Säure (HA) und ihrer konjugierten Base (B) besteht.
(Säure) ⇌ (Wasserstoffion) + (konjugierte Base)
Wie ein Puffer funktioniert
Wenn zu einem Gleichgewichtsgemisch aus einer schwachen Säure und ihrer konjugierten Base eine starke Säure (mehr H+) zugegeben wird, verschiebt sich das Gleichgewicht nach dem Prinzip von Le Chatelier nach links. Bei der Zugabe einer starken Base zu dem Gemisch sinkt die Wasserstoffionenkonzentration wiederum weniger, als es für die zugegebene Basenmenge zu erwarteten wäre.
Bei dem Ansetzen eines Puffers gibt es ein paar allgemeine Richtlinien, die Sie beachten sollten:
- Kalibrieren Sie das pH-Meter; idealerweise bei pH-Werten ober- und unterhalb des Zielwerts der Pufferlösung Zu diesem Zweck gibt es kalibrierte Pufferlösungen im Handel
- Wiegen Sie das Puffersalz ab, um die gewünschte Pufferkonzentration zu erhalten
- Geben Sie es in einen Messkolben, fügen Sie Wasser in HPLC-Qualität hinzu und schütteln Sie gründlich, um eine Lösung zu erhalten
- Messen Sie mit einer pH-Sonde und einem pH-Meter den pH-Wert der Lösung
- Stellen Sie den pH-Wert durch Zugabe kleiner Mengen starker Säure und/oder starker Base auf den gewünschten Wert ein
- Sobald der pH-Wert korrekt ist, füllen Sie die Lösung auf das gewünschte Endvolumen auf und mischen Sie gut
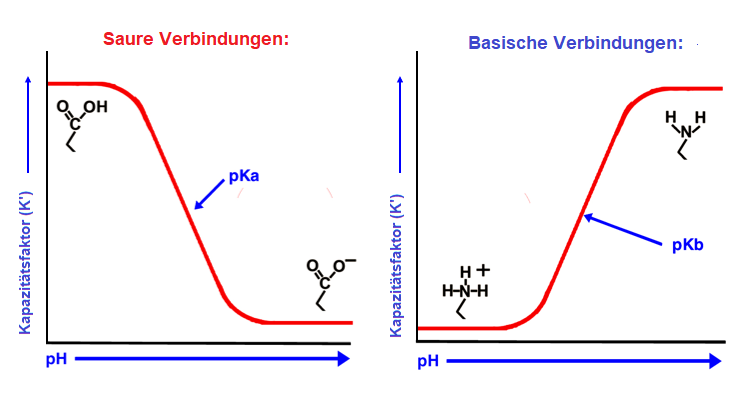
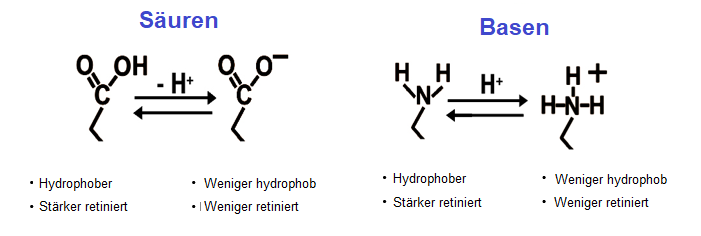
In der HPLC werden Puffer typischerweise verwendet, um sekundäre Wechselwirkungen zu kontrollieren, die in der chromatographischen Welt im Allgemeinen als "unerwünscht" angesehen werden. Sie werden auch verwendet, um den Ionisierungszustand des Analyten zu kontrollieren. Das stellt sicher, dass er nicht in mehr als einem Ionisierungszustand vorliegt. Der pKs einer Verbindung gibt den pH-Wert an, bei dem sie zu 50% ionisiert und zu 50% neutral ist. Wenn Sie bei diesem pH-Wert arbeiten, werden Sie breite oder geteilte Peaks und variable Retentionszeiten sehen. Alle Methoden sollten bei einem pH-Wert arbeiten, der mindestens zwei pH-Einheiten vom pKs ihres Zielanalyten entfernt ist.
Bei der Herstellung von isokratischen mobilen Phasen gibt es ein paar weitere Überlegungen, um eine gute Methodenrobustheit zu gewährleisten
- Mischen Sie Ihre mobile Phase nach Möglichkeit vor, um Fehler durch die Pumpe zu vermeiden
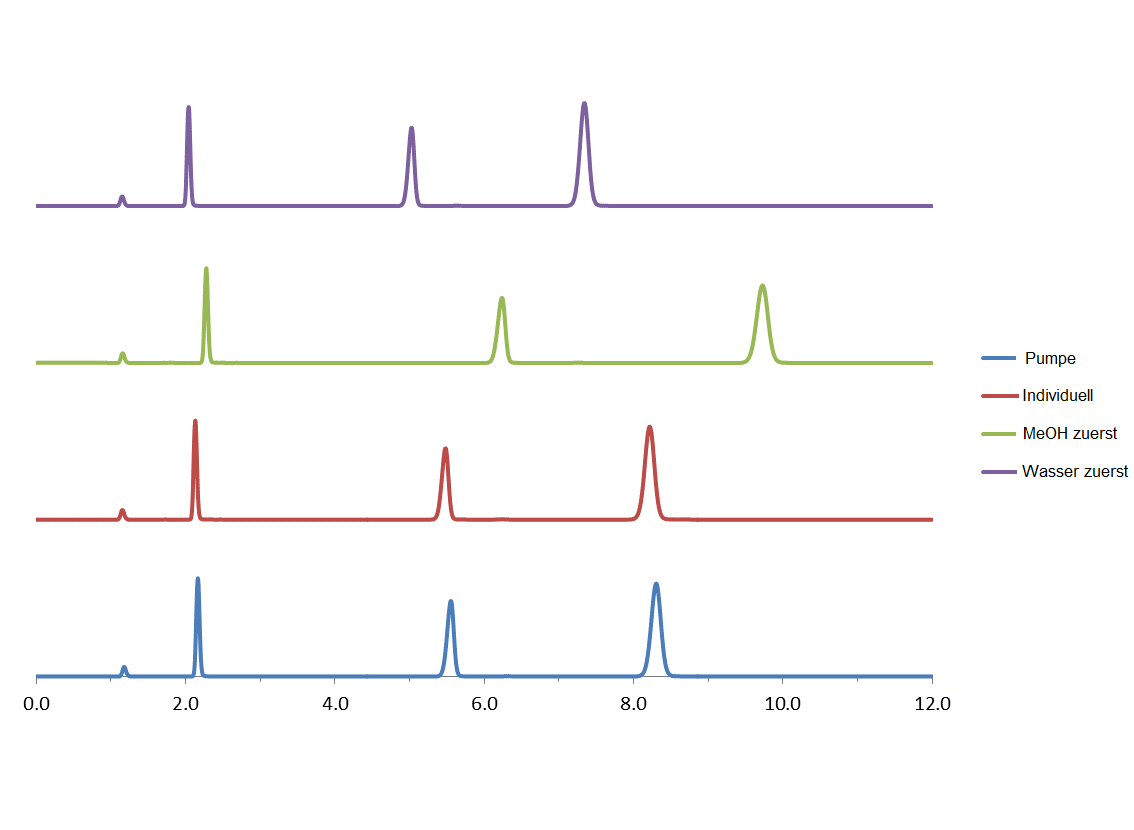
- Verwenden Sie immer die gleiche Methode für die Herstellung; wenn Sie z. B. das Wasser zuerst hinzugeben, sollten Sie es immer zuerst hinzugeben. Wenn Sie die einzelnen Komponenten zunächst abmessen und dann mischen, sollten Sie dies immer so machen. Ändern Sie dieses Verfahren nicht, da die Ergebnisse in Bezug auf die Retentionszeit der Analyten stark variieren können.
Im Folgenden finden Sie ein Experiment, das diese Variabilität zeigt, wenn die mobilen Phasen auf folgende Weise gemischt wurden
- Wasser zuerst: 400 mL Wasser im Messzylinder abmessen, in einen 1-Liter-Messkolben geben und mit MeOH bis zur Markierung auffüllen
- MeOH zuerst: 600 mL MeOH im Messzylinder abmessen, in einen 1-Liter-Messkolben geben und bis zur Markierung mit Wasser auffüllen
- MeOH und Wasser einzeln abmessen: 600 mL MeOH im Messzylinder abmessen und ins Reservoir für die mobile Phase überführen; 400 mL Wasser in denselbem Messzylinder abmessen und ins Reservoir für die mobile Phase überführen
- Pumpe zum Mischen von A = Wasser mit B = MeOH laufen lassen
Flussrate 1.25mL/min
Inj Vol 2µL
Pufferkonzentrationen sind ebenfalls wichtig. Es wird allgemein davon ausgegangen, dass Konzentrationen unter 10 mM nicht die Pufferkapazität bieten, die zur Kontrolle der Silanolaktivität oder des Ionisierungszustands einer Verbindung erforderlich ist. 10 mM werden als minimale effektive Konzentration für die Umkehrphase und HILIC angesehen. Für andere Techniken, wie z. B. den Größenausschluss, sind wesentlich höhere Konzentrationen erforderlich. Es ist nicht ungewöhnlich, dass für diese Methoden Konzentrationen von über 100 mM eingesetzt werden. Die Pufferkonzentration muss sorgfältig überlegt sein, um sicherzustellen, dass die Löslichkeit unter allen Bedingungen erreicht werden kann. Wenn Sie unter Reversed-Phase-Bedingungen arbeiten, müssen Sie möglicherweise die Konzentration des Puffers, mit dem Sie arbeiten möchten, begrenzen, wenn die Methode einen hohen Organikanteil enthält (z. B. bei einem Gradienten), um sicherzustellen, dass der Puffers nicht ausfällt.
Die mobile Phase kann genauso viel zur Selektivität beitragen wie Ihre stationäre Phase. Sorgfalt bei ihrer Auswahl und Herstellung ist deshalb genauso wichtig wie das Austesten von stationären Phasen bei der Entwicklung von robusten HPLC-Methoden.
