Wskazówki techniczne HPLC / UHPLC
Poziom: średniozaawansowany
Systematyczne podejście do opracowywania metod HPLC dla związków chiralnych
Jak wybrać odpowiednią chiralną fazę stacjonarną dla mojego analitu?
Jak na podstawie struktury analitu określić, której kolumny użyć?
Która kolumna w odwrócym układzie faz będzie najlepsza do rozdzielenia X?
Rozdzielanie chromatograficzne zachodzi, gdy faza stacjonarna i faza ruchoma zapewnia środowisko, w którym można wyrazić różnicę selektywności między analitami o różnych właściwościach chemicznych. Na przykład w chromatografii faz odwróconych (RP) anality są zatrzymywane przez fazę stacjonarną na zasadzie oddziaływań hydrofobowych, a następnie wymywane w kolejności rosnącej hydrofobowości. W przypadku enancjomerów właściwości chemiczne i fizyczne są identyczne, a zatem do uzyskania separacji wymagane jest rozpoznawanie chiralności.
Mechanizm separacji związków chiralnych polega na tworzeniu kompleksu diastereomerycznego, albo między dodatkiem fazy ruchomej a analitem będącym przedmiotem zainteresowania, albo między fazą stacjonarną a analitem. Po utworzeniu możliwe jest rozdzielenie enancjomerów, ponieważ kompleks diastereomeryczny ma różne właściwości lub ze względu na stabilność utworzonego kompleksu, przy czym jeden enancjomer jest preferencyjnie zatrzymywany nad drugim. Zastosowanie chiralnych modyfikatorów w fazie ruchomej, choć możliwe, generalnie nie jest stosowane w HPLC (choć jest stosowane w elektroforezie kapilarnej), ponieważ koszt takich dodatków sprawia, że opcja ta jest ekonomicznie nieopłacalna w większości przypadków. Rodzaje chiralnych faz stacjonarnych stosowanych na przestrzeni lat obejmują:
• Fazy Pirkle'a. W pełni syntetyczne fazy oparte na modyfikowanych aminokwasach. Zapewniają chiralne rozpoznawanie, oferując 3 punkty interakcji. Faza jest zazwyczaj wiązana chemicznie, więc wytrzymałość jest dobra. Ten typ fazy generalnie wykazuje niską skuteczność, ale oferuje dobrą selektywność, gdy działa.
• Fazy oparte na cyklodekstrynach. W pełni syntetyczne fazy wiązane, działające na zasadzie wykluczenia, w których jeden enancjomer jest w stanie dokładniej dopasować się do struktury "chiralnego wiadra" niż drugi.
• Fazy oparte na białkach. Białka takie jak BSA są powlekane na krzemionce, oferując szerszy zakres oddziaływań chiralnych, rozdzielczość może nie być tak dobra jak w przypadku faz Pirkle lub cyklodekstryn, ale kolumny te oferują szerszy zakres selektywności. W przypadku faz białkowych należy zachować ostrożność, aby nie zniszczyć fazy lub nie zmyć jej z podłoża krzemionkowego podczas użytkowania.
• Wymiana ligandów. Mechanizm wymiany ligandów wykorzystuje penicylaminę w połączeniu z fazą ruchomą, która zawiera jony miedzi II w dość specyficzny sposób. Jony te tworzą kompleksy z aminokwasami, umożliwiając ich rozdzielenie.
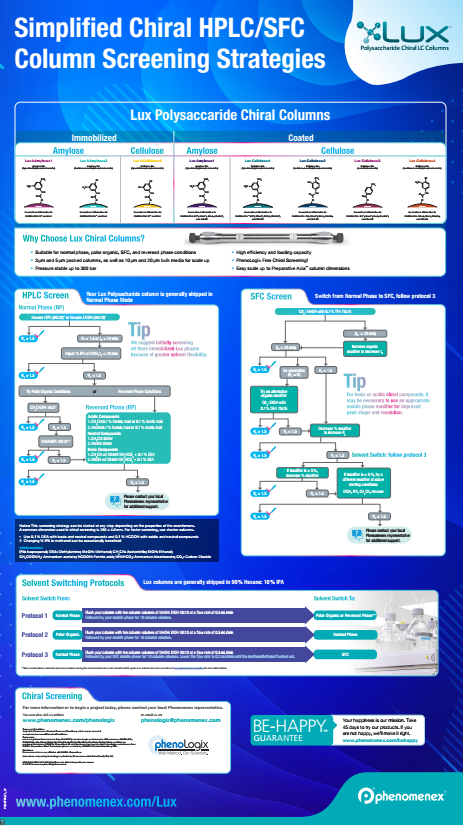
• Fazy stacjonarne na bazie polisacharydów. Są one oparte na naturalnie występujących chiralnych polimerach celulozy lub amylozy, polimery są derywatyzowane w celu zapewnienia dodatkowych interakcji. W zależności od zastosowanych rozpuszczalników, polimery pęcznieją w różnym stopniu, co tworzy "kieszenie chiralne" w strukturze, dostępne lub nie dla analitów, umożliwiając ich separację. Najnowsze osiągnięcia w tym zakresie obejmują immobilizację takich faz, co pozwala na stosowanie szerszego zakresu rozpuszczalników niż było to możliwe wcześniej. Rozpuszczalniki takie jak DMSO i DMF mogą być wykorzystywane, co może być pomocne przy rozważaniu separacji na skalę preparatywną, w których rozpuszczalność analitu może stanowić wyzwanie.
Biorąc pod uwagę elastyczność, jaką oferują fazy polisacharydowe, umożliwiając prowadzenie separacji w fazie normalnej, odwróconej, polarnej organicznej i SFC z wysoką wydajnością, fazy te stały się kolumnami pierwszego wyboru dla wielu użytkowników prowadzących separacje chiralne. Fazy te oferują wysoką skuteczność, co z kolei zwiększa prawdopodobieństwo znalezienia zestawu warunków, które zapewnią skuteczną separację. Ze względu na złożony charakter oddziaływań między enancjomerami i chiralną fazą stacjonarną, nie jest możliwe dokładne przewidzenie, która faza stacjonarna zapewni dobre rozdzielenie. Konieczne jest zatem sprawdzenie różnych kombinacji fazy stacjonarnej i fazy ruchomej w celu uzyskania najlepszej separacji. Podczas testowania naszej gamy faz polisacharydowych, Lux, sprawdzamy wszystkie 3 tryby: fazę normalną, fazę odwróconą i polarny tryb organiczny. Kolumny Lux mogą być również z powodzeniem stosowane w warunkach SFC, jeśli użytkownicy mają dostęp do tej technologii.
Sprawdzamy następujące fazy:
Testowanie można również przeprowadzić w warunkach przyjaznych dla LC-MS, jeśli jest to wymagane. Dokładne szczegóły dotyczące tego typu testów można znaleźć, przeglądając poniższy plakat.
Po sprawdzeniu różnych kombinacji konieczne jest dokonanie przeglądu uzyskanych wyników, w razie potrzeby wybierając jeden lub dwa najbardziej obiecujące do optymalizacji. Jest to najskuteczniejszy sposób na opracowanie separacji o dobrej rozdzielczości i odporności.
Plakat Lux Chiral Screening
Uproszczone strategie opracowywania metod dla chiralnych kolumn HPLC/SFC - faza normalna, polarna faza organiczna i faza odwrócona
Znaki towarowe
Lux jest znakiem towarowym firmy Phenomenex.