HPLC/UHPLC Technischer Tipp
Niveau: Mittel
Ein systematischer Ansatz für das chirale Screening und die Methodenentwicklung
Wie wähle ich die richtige chirale stationäre Phase für meinen Analyten aus?
Wie bestimme ich beim Betrachten der Struktur des Analyten, welche Säule zu verwenden ist?
Benötige ich eine chirale Umkehrphasen-Säule, um X zu trennen?
Tipps in anderen Sprachen
Eine chromatographische Trennung wird erreicht, wenn die Kombination aus stationärer Phase und mobiler Phase eine Umgebung liefert, in der Selektivität zwischen Analyten mit unterschiedlichen chemischen Eigenschaften erzielt werden kann. In der Umkehrphasen-Chromatographie werden beispielsweise Analyten von der stationären Phase durch hydrophobe Wechselwirkungen festgehalten und dann in der Reihenfolge ihrer zunehmenden Hydrophobizität eluiert. Bei Enantiomeren sind deren chemische und physikalische Eigenschaften identisch und daher ist eine Form von chiraler Erkennung erforderlich, um eine Trennung zu erreichen.
Der Mechanismus für die Durchführung chiraler Trennungen beinhaltet die Bildung eines diastereomeren Komplexes, entweder zwischen einem Additiv der mobilen Phase und dem interessierenden Analyten oder zwischen der stationären Phase und dem Analyten. Einmal gebildet, ist es möglich, die Enantiomere zu trennen, entweder weil die diastereomeren Komplexe unterschiedliche Eigenschaften haben oder aufgrund der unterschiedlichen Stabilität der gebildeten Komplexe, wobei ein Enantiomer gegenüber dem anderen bevorzugt zurückgehalten wird. Die Verwendung von chiralen Additiven in der mobilen Phase ist zwar möglich, wird aber in der HPLC (obwohl sie in der Kapillarelektrophorese verwendet werden) im Allgemeinen nicht eingesetzt, da die Kosten solcher Additive diese Option in den meisten Fällen wirtschaftlich unrentabel machen. Zu den Arten der chiralen stationären Phasen, die im Laufe der Jahre entwickelt wurden, gehören:
• Pirkle-Phasen. Vollsynthetische Phasen basierend auf funktionalisierten Aminosäuren. Diese Phasen erzielen eine chirale Erkennung, indem sie 3 unterschiedliche Interaktionspunkte bieten. Die chiralen Liganden sind normalerweise chemisch gebunden, daher ist die Robustheit gut. Diese Art von Phasen weisen im Allgemeinen niedrige Trefferraten auf, bieten aber eine gute Selektivität, wenn alles klappt.
• Phasen auf Cyclodextrinbasis. Vollsynthetische, gebundene Phasen, die nach dem Ausschlussprinzip funktionieren, wobei ein Enantiomer besser in die "chirale Korb-Struktur" passt als das andere.
• Proteinbasierte Phasen. Siliciumdioxid wird mit Proteinen wie BSA beschichtet, die ein breiteres Spektrum an chiralen Interaktionen bieten. Die Effizienz ist vielleicht nicht so gut wie bei Pirkle- oder Cyclodextrin-Phasen, aber diese Säulen bieten ein breiteres Spektrum an chiraler Selektivität. Bei Phasen auf Proteinbasis muss darauf geachtet werden, die Phase nicht zu "vergiften" oder sie während des Gebrauchs vom Siliciumdioxidträger abzuwaschen.
• Ligandenaustausch-Phasen. Der Mechanismus des Ligandenaustauschs verwendet Penicillamin als Ligand in Kombination mit einer mobilen Phase, die Kupfer-II-Ionen in einer spezifischen Konzentration enthält. Die Ionen bilden Komplexe z.B. mit Aminosäuren, wodurch deren Trennung ermöglicht wird.
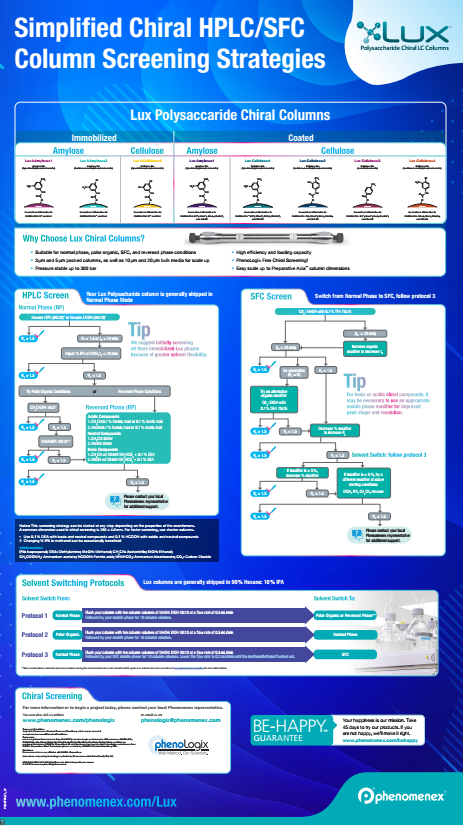
• Polysaccharid-basierte stationäre Phasen. Diese bestehen aus den natürlich vorkommenden chiralen Polymeren Cellulose oder Amylose. Die Polymere sind derivatisiert, um zusätzliche Wechselwirkungen zu ermöglichen. Abhängig von den verwendeten Lösungsmitteln quellen die Polymere unterschiedlich stark auf, wodurch "chirale Taschen" innerhalb der Struktur entstehen. Diese ermöglichen es den Analyten, in und aus der Struktur zu diffundieren und bewirken so die chirale Trennung. Zu den jüngsten Entwicklungen gehört es, solche Phasen zu immobilisieren, wodurch ein breiteres Spektrum an Lösungsmitteln als bisher eingesetzt werden kann. Es können Lösungsmittel wie DMSO und DMF verwendet werden. Diese können bei präparativen Trennungen hilfreich sein, bei denen die Löslichkeit des Analyten eine Herausforderung darstellen kann.
Polysaccharidphasen bieten eine hohe Flexibilität, da sie die Durchführung von Normalphasen-, Umkehrphasen-, polar-organischen und SFC-Trennungen mit hoher Effizienz ermöglichen. Daher sind diese Phasen für viele Anwender zur ersten Säulenwahl für chirale Trennungen geworden. Die Phasen bieten hohe Trefferraten, was wiederum die Wahrscheinlichkeit erhöht, die richtigen Bedingungen für eine effektive chirale Trennung zu finden. Aufgrund der komplexen Natur der Wechselwirkungen zwischen Enantiomeren und einer chiralen stationären Phase ist es nicht möglich, genau vorherzusagen, welche stationäre Phase eine gute Trennung gewährleistet. Es ist daher notwendig, verschiedene stationäre Phase und Zusammensetzungen der mobilen Phase zu screenen, um die beste Kombination für eine erfolgreiche chirale Trennung zu finden. Bei der Methodenentwicklung mit unseren Polysaccharid-basierten Lux-Phasen screenen wir standardmäßig alle 3 Modi: Normalphase, Umkehrphase und polar-organisch. Lux-Säulen können auch unter SFC-Bedingungen erfolgreich eingesetzt werden, wenn die Anwender Zugang zu dieser Technologie haben. Wir screenen die folgenden Phasen:
Das Screening kann bei Bedarf auch nur unter LC-MS-freundlichen Bedingungen durchgeführt werden. Genaue Details zur Methodenentwicklung finden Sie auf dem untenstehenden Poster zum chiralen Screening.
Nach Abschluss des Screenings ist es dann notwendig, die erzielten Ergebnisse zu beurteilen und das oder die vielversprechendsten zur gegebenenfalls weiteren Optimierung auszuwählen. Es hat sich herausgestellt, dass dies der effektivste Weg ist, chirale Trennungen mit guter Auflösung und Robustheit zu entwickeln.
Lux Chiral Screening Poster
Vereinfachte Screening-Strategien für chirale HPLC/SFC-Säulen - Normalphasen, polar-organische Phasen und umgekehrte Phasen
Marken
Lux ist eine Marke von Pehnomenex.